Forskere demonstrerer alsidighed af solid-state protein sensor

Dette transmissionselektronmikrofotografi viser en solid-state nanopore:Den hvide cirkel i midten af billedet. Den ellers ujævn udseende struktur skyldes den polykrystallinske natur af en guldfilm, der blev fordampet på siliciumnitridmembranen (som ikke kan ses). Kredit:Rant gruppe, TU MuenchenCopyright TU Muenchen
En ny type sensor, baseret på porer i nanometerskala i en halvledermembran, er et skridt tættere på praktisk anvendelse i applikationer som at analysere proteinindholdet i en enkelt celle. Forskere, der er banebrydende enkelt-molekyle nanopore sensorteknologi ved Technische Universität München (TUM), har vist sit potentiale gennem en række eksperimenter i løbet af de sidste par år. Nu, i samarbejde med biokemikere ved Goethe Universitet Frankfurt, de har været i stand til at fremme denne indsats forbi det, der havde været et stikpunkt:Forbedring af sensorens selektivitet, samtidig med at dens følsomhed over for enkeltmolekyler bevares. De rapporterer de seneste resultater i Natur nanoteknologi .
Forskning, der sigter mod at fremstille og kontrollere diagnostiske anordninger på skalaen af biologiske molekyler, har udviklet sig til det punkt, hvor flere forskellige tilgange ses som konkurrencedygtige for praktisk anvendelse i den relativt nær fremtid. Målet er ikke at skabe en universel, bredspektret sensor, men snarere en teknologi til at detektere og identificere enkelte molekyler af specifikt målrettede proteiner – uden at det er nødvendigt at modificere dem ved at tilføje biokemiske "etiketter". Sådan teknologi kan bruges, for eksempel, at fremskynde oversættelsen af indsigter fra genomik til praktisk viden om proteomik. Dette er af vital interesse for medicinsk og farmaceutisk forskning såvel som for mere fundamentale biologiske undersøgelser. En anden ofte nævnt potentiel anvendelse er påvisning af biologiske krigsførelsesmidler.
En af de mest lovende tilgange er baseret på at konstruere et molekylært "kontrolpunkt, " en overvåget passage mellem to saltopløsninger adskilt af en kunstig membran. Denne såkaldte nanopore er dimensioneret og formet således, at molekyler skal passere igennem et ad gangen. Et molekyles tilstedeværelse i banen producerer målbare ændringer i elektrisk ledningsevne over nanoporen, og yderligere forbedringer kan finjustere en sådan detektor for at gøre den til en meget specifik "identitetskontrol" for målrettede molekyler. Hvad München-Frankfurt-samarbejdet har muliggjort, er en robust og reversibel metode til at udføre denne finjustering:at udstyre en uorganisk nanoporesensor med biologisk funktionalitet ved at forankre molekylære receptorer inde i den. Holdene blev ledet af Dr. Ulrich Rant, af TUMs Walter Schottky Institute og TUM Institute for Advanced Study, og Prof. Dr. Robert Tampé fra Institut for Biokemi ved Goethe Universitetet i Frankfurt og Cluster of Excellence Frankfurt (CEF) Macroolecular Complexes.
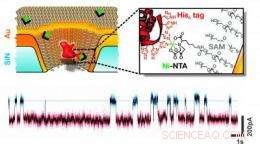
Denne skematiske illustration viser en guldbelagt faststof-nanopore, der er kemisk modificeret med en enkelt receptor, der er i stand til at binde proteinmolekyler med et specifikt sæt aminosyrerester. Et eksempel på strøm-vs.-tid-spor viser den forbigående binding af enkelte proteiner. Kredit:Rant group, TU München, Copyright TU Muenchen.
"Det jeg synes er fantastisk ved nanoporer, "Rant siger, "er deres omkostningseffektivitet:Du kan allerede køre enkelt-molekyle eksperimenter med udstyr til en værdi af kun et par tusinde euro. Hvis teknologien kommercialiseres yderligere, Jeg er sikker på, at instrumenter kunne sælges til prisen for en personlig computer, potentielt giver folk mulighed for at opdage enkelte molekyler derhjemme."
Fremstilling af disse eksperimentelle anordninger begyndte med et substrat af siliciumnitrid kun 50 nanometer tykt; således var membranen bogstaveligt talt en halvlederchip (dog ikke, selvfølgelig, et integreret kredsløb). Standardværktøjer fra mikroelektronikindustrien, elektronstråle litografi og reaktiv ionætsning, blev brugt til at gennembore siliciumnitridmembranen med nanoporer på 20 til 50 nm i diameter. Dampaflejring blev brugt til at belægge porerne med titanium og guld, og metallet modtog til gengæld en selvsamlet kemisk belægning et molekylært lag tykt. De resulterende nanoporer havde en tilspidset konisk form med en diameter i den smalle ende på omkring 25 nm; forankret i overfladelaget var et lille antal biokemiske receptorer designet til at fange og immobilisere det protein, der ville give sensoren dens biologiske funktionalitet. Til disse eksperimenter, chipsene blev monteret i et målekammer med en elektrolytopløsning på hver side; proteinmolekyler tilføjet til den ene side af kammeret blev presset gennem nanoporen af en elektrisk ladning. Spor af ændringer i elektrisk strøm gav realtidsmålinger af enkelte molekyler, da de passerede gennem nanoporerne - eller dvælede, mens de interagerede med det immobiliserede protein - og disse data gav igen positiv identifikation af målmolekyler.

Denne kunstners gengivelse illustrerer, hvordan enkelte proteiner sonderes med en kunstigt konstrueret nanopore i en metalliseret faststofmembran. Aprimært protein (mørkerødt) forankret i poren binder forbigående anIgG-antistof (lyserødt), der passerer gennem poren. Interaktionstiden kan måles elektrisk (en eksemplarisk strøm-vs.-tid-sporing er vist øverst på billedet); dette afslører antistoffets biologiske funktion. Et tæppe af selvsamlede molekyler (hvide hår) bruges til at belægge guldporevæggene, gør overfladen biologisk inert. Kredit:Christof Hohmann, Excellence Cluster Nanosystems Initiative Munich (NIM), copyright NIM
Forskerne var i stand til at påvise rekombinante histidin-mærkede proteiner, og også at skelne mellem underklasser af naturlige IgG-antistoffer (fra rotter og hamstere). I fortiden, dette niveau af selektivitet kunne kun opnås på bekostning af enkelt-molekyle følsomhed. Resultaterne rapporteret i Natur nanoteknologi vise, at denne hindring kan overvindes, og mere til – at tilgangen er ekstremt alsidig. Som Rant forklarer, "Den metode, vi brugte til at forankre enkelte proteiner inde i poren, er ret generisk og fungerer for mange tilgængelige rekombinante proteiner. Derfor er det nemt at udstyre faststof-nanoporen med den ønskede biologiske funktionalitet. Vælg blot et passende protein, som specifikt genkender målproteiner af interesse, og bruge det til at sondere proteiner, når de passerer forbi."
"Fremtiden forbliver spændende, " siger Tampé, "fordi naturen er langt foran os med hensyn til selektivitet og specificitet. Derfor er der behov for yderligere forbedringer inden for kunstige sensoriske systemer på molekylært niveau. Samarbejdet mellem München- og Frankfurt-teamene repræsenterer et vigtigt skridt i biosensorisk og nanodiagnostisk teknologi på niveauet af enkelte molekyler." Rant tilføjer, "Det meste af den seneste nanopore-forskning har været rettet mod DNA-detektion og -sekventering. Jeg håber, vores resultater viser, at nanoporer har potentialet til også at blive vigtige værktøjer til proteinforskning. Og hvem ved? Måske vil vi snart se introduktionen af protein nanopore sensorer som diagnostiske instrumenter til at detektere sygdomsmarkører med lav overflod i patienters prøver."
 Varme artikler
Varme artikler
-
 Forskere tager celler fra chrysalis og bruger dem til at dyrke sommerfuglvinger i laboratorietMorpho didius - Museumseksemplar. Kredit:Wikipedia Et par forskere, en fra Oxford University, den anden med Natural History Museum i London, har fundet en måde at dyrke sommerfuglvinger på i deres
Forskere tager celler fra chrysalis og bruger dem til at dyrke sommerfuglvinger i laboratorietMorpho didius - Museumseksemplar. Kredit:Wikipedia Et par forskere, en fra Oxford University, den anden med Natural History Museum i London, har fundet en måde at dyrke sommerfuglvinger på i deres -
 Kulstof ny mester:Teoretikere beregner atom-tykke carbyne-kæder kan være det stærkeste materiale …Forskere fra Rice University har ud fra første-princip-beregninger fastslået, at carbyne ville være det stærkeste materiale, der endnu er opdaget. Kulstofatomkæderne ville være svære at lave, men vill
Kulstof ny mester:Teoretikere beregner atom-tykke carbyne-kæder kan være det stærkeste materiale …Forskere fra Rice University har ud fra første-princip-beregninger fastslået, at carbyne ville være det stærkeste materiale, der endnu er opdaget. Kulstofatomkæderne ville være svære at lave, men vill -
 Kemikere lukker hullet i at gøre nanomedicin sikrere, mere effektivtFra venstre:Drs. Xingya Jiang, Jie Zheng og Bujie Du forsker i nanopartiklers adfærd i kroppen på Natural Science and Engineering Research Laboratory på UT Dallas campus. Forskerne offentliggjorde en
Kemikere lukker hullet i at gøre nanomedicin sikrere, mere effektivtFra venstre:Drs. Xingya Jiang, Jie Zheng og Bujie Du forsker i nanopartiklers adfærd i kroppen på Natural Science and Engineering Research Laboratory på UT Dallas campus. Forskerne offentliggjorde en -
 Miniaturiserede ultrasmå platincylindre svækkes, når deres bestanddele reduceres i antalSimuleret deformation af en platin nanopiller under stigende niveauer af kompression fra venstre mod højre. Kredit:2012 American Chemical Society Miniaturisering af mikroskopiske metalliske objekt
Miniaturiserede ultrasmå platincylindre svækkes, når deres bestanddele reduceres i antalSimuleret deformation af en platin nanopiller under stigende niveauer af kompression fra venstre mod højre. Kredit:2012 American Chemical Society Miniaturisering af mikroskopiske metalliske objekt
- Nanomaskiner til bioniske proteiner
- Denne RNA-baserede teknik kunne gøre genterapi mere effektiv
- Nyt stål for at fordoble levetiden for oliefeltsrørledninger
- Bosch stopper service for deling af scootere i Europa
- Hvordan engangsbleer kan forbedre målinger af tumorvækst
- Astrofysikere bekræfter hjørnestenen i Einsteins relativitetsteori


