Proteinstruktur kan låse op for nye behandlinger for cystisk fibrose
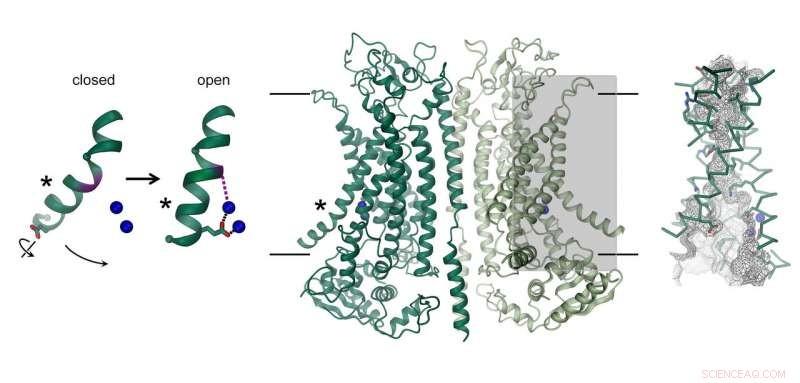
Struktur af den calciumaktiverede chloridkanal TMEM16A. Kanalen, som består af to identiske underenheder, er vist i midten. Membranens position er angivet med linjer. Ionledningsporen er fremhævet (gråt rektangel) og vist i detaljer til højre. Billedet til venstre viser bevægelsen af en α-helix, der fører til kanalåbning. Bundne calciumioner er afbildet som blå kugler. Kredit:Raimund Dutzler, UZH
Biokemikere ved universitetet i Zürich har brugt kryo-elektronmikroskopi til at bestemme den detaljerede arkitektur af kloridkanalen TMEM16A. Dette protein er et lovende mål for udviklingen af effektive lægemidler til behandling af cystisk fibrose.
Cystisk fibrose er en alvorlig arvelig lungesygdom, som der i øjeblikket ikke er nogen kur mod. Den underliggende årsag til sygdommen er en funktionsfejl i chloridkanalen CFTR, som forhindrer udskillelse af chlorid i visse kropsceller. Dette fører til dehydrering af slimlaget i lungen. En lovende tilgang til behandling af cystisk fibrose er aktiveringen af den calciumaktiverede chloridkanal TMEM16A som en alternativ vej til chloridudstrømning. Da TMEM16A udtrykkes i det samme epitel som CFTR, dets aktivering kunne genoprette hydrering af slimlaget. TMEM16A er en del af en proteinfamilie, hvis medlemmer letter strømmen af negativt ladede chloridioner eller lipider hen over cellemembranen.
Struktur af en chloridkanal bestemt
Strukturen af en TMEM16 scramblase, som fungerer som en lipidtransportør og spiller en vigtig rolle i blodkoagulation, var allerede kendt fra tidligere arbejde. Det er nu også lykkedes forskere ved Institut for Biokemi ved Zürich Universitet at dekryptere strukturen af kloridkanalen TMEM16A. For at gøre det, teamet ledet af professor Raimund Dutzler brugte kryo-elektronmikroskopi (kryo-EM), en teknik, hvis pionerer for nylig blev tildelt Nobelprisen i kemi. "Dette membranproteins molekylære arkitektur er afgørende for målrettet udvikling af lægemidler til behandling af cystisk fibrose, "understreger Dutzler.
Opdagelse af en ny aktiveringsmekanisme
Kloridkanalen TMEM16A findes i forskellige organer i kroppen og spiller en central rolle i udskillelsen af klorid i lungen, sammentrækning af glatte muskler, og opfattelsen af smerte. Hvordan dets struktur adskiller sig fra nært beslægtede scramblaser af samme familie, og hvordan proteinet aktiveres af calcium, blev nu afsløret gennem en kombination af kryo-EM og elektrofysiologi. Mens dens generelle arkitektur ligner scramblases af den samme familie, der er tydelige forskelle i poreregionen placeret i hver underenhed af det dimere protein. Scramblases indeholder en membraneksponeret polar fure, som muliggør diffusion af lipidhovedgrupper hen over lipid -dobbeltlaget. I modsætning, samme sted, TMEM16A danner en timeglasformet proteinomsluttet kanal, som lukkes i fravær af calcium. Bindingen af positivt ladede calciumioner i dens nærhed åbner kanalen og tillader negativt ladede chloridioner at trænge igennem membranen. "Denne aktiveringsmekanisme er unik, da de bundne calciumioner direkte ændrer strukturen og elektrostatikken i ionpermeationsporen, "forklarer Cristina Paulino, hovedforfatter af undersøgelsen.
Baner vejen for nye terapier
Resultaterne, der beskriver strukturen og funktionen af TMEM16A, baner vejen for en mekanistisk forståelse af denne vigtige familie af membranproteiner, og de giver en lovende skabelon til udvikling af lægemidler til behandling af cystisk fibrose. "Stoffer, der fører til aktivering af TMEM16A, vil kompensere for defekten i udskillelsen af chloridioner i lungen, "fastslår Raimund Dutzler.
 Varme artikler
Varme artikler
-
 Forskere rapporterer den hurtigste oprensning af astatin-211, der er nødvendig for målrettet kræf…Dræber T-celler omgiver en kræftcelle. Kredit:NIH I en nylig undersøgelse, Forskere fra Texas A&M University har beskrevet en ny proces til at rense astatin-211, en lovende radioaktiv isotop til m
Forskere rapporterer den hurtigste oprensning af astatin-211, der er nødvendig for målrettet kræf…Dræber T-celler omgiver en kræftcelle. Kredit:NIH I en nylig undersøgelse, Forskere fra Texas A&M University har beskrevet en ny proces til at rense astatin-211, en lovende radioaktiv isotop til m -
 Forskere designer måde at bruge harmløse bakterier til at opdage tungmetaller i drikkevand(L-R) Gregoire Thouvenin og Nicholas Csicsery i UCSD Biodynamics Lab drevet af bioingeniør- og biologiprofessor Jeff Hasty ved UC San Diego. Kredit:University of California - San Diego Når det ko
Forskere designer måde at bruge harmløse bakterier til at opdage tungmetaller i drikkevand(L-R) Gregoire Thouvenin og Nicholas Csicsery i UCSD Biodynamics Lab drevet af bioingeniør- og biologiprofessor Jeff Hasty ved UC San Diego. Kredit:University of California - San Diego Når det ko -
 Første store undersøgelse af kokainbrugere fører til gennembrud inden for lægemiddeltestEn bunke kokainhydrochlorid. Kredit:DEA Drug Enforcement Agency, offentligt domæne Forskere fra University of Surrey har udviklet en hurtig og meget følsom fingeraftrykstest, der kan tage kun seku
Første store undersøgelse af kokainbrugere fører til gennembrud inden for lægemiddeltestEn bunke kokainhydrochlorid. Kredit:DEA Drug Enforcement Agency, offentligt domæne Forskere fra University of Surrey har udviklet en hurtig og meget følsom fingeraftrykstest, der kan tage kun seku -
 Ultralet aluminium:Kemikere rapporterer gennembrud inden for materialedesignSkematisk afbildning af en supertetrahedral aluminiumkrystalstruktur. Forskere fra Utah State University, USA og Southern Federal University, Rusland, beregningsmæssigt designet en ny, metastabil, ult
Ultralet aluminium:Kemikere rapporterer gennembrud inden for materialedesignSkematisk afbildning af en supertetrahedral aluminiumkrystalstruktur. Forskere fra Utah State University, USA og Southern Federal University, Rusland, beregningsmæssigt designet en ny, metastabil, ult
- Påfugle bliver dræbt af dyrearter?
- Sådan fungerer Boeing Dreamliner
- Dødelig arktisk kulde belaster ressourcer i det amerikanske Midtvesten
- Asdex Upgrade eksperimentelle facilitet genererer sin første plasma
- Klima forandring, vand og spredning af sygdomme:Forbind prikkerne forskelligt
- Forsker sætter rekord for kvantekemiberegninger


