Simpel one-pot syntese af tricykliske peptider, der kan droppes
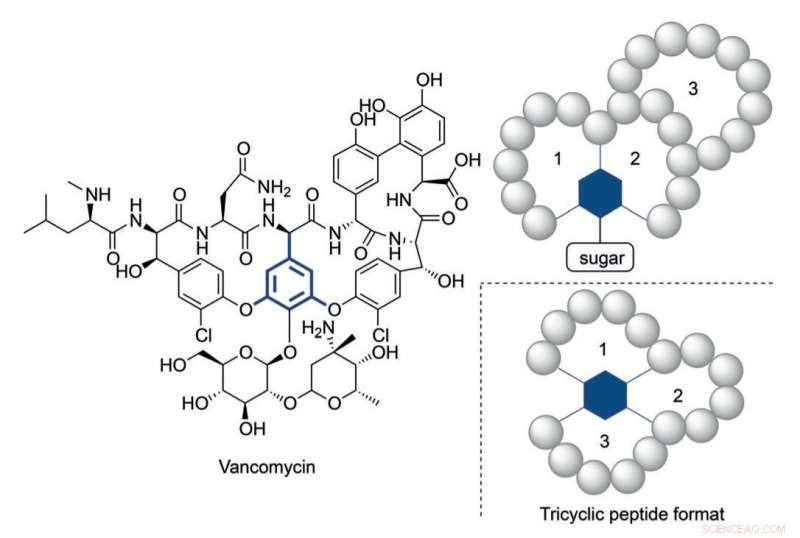
Struktur af vancomycin og et tricyklisk peptidformat inspireret af dets multicykliske struktur. Kredit:HIMS
Kemikere ved University of Amsterdams Van 't Hoff Institute for Molecular Sciences (HIMS) og Pepscan (Lelystad) har udviklet en ny metode til at låse lineære peptider til stærkt afstivede tricykliske strukturer med farmaceutisk potentiale. Deres fund er netop blevet rapporteret i Angewandte Chemie .
Metoden, udviklet af HIMS Ph.D. studerende Gaston Richelle, muliggør parallel syntese af flere tricykliske peptider i et bibliotekformat. Dette tillader efterfølgende biologisk screening for at identificere nye peptidterapeutika.
Højere strukturel kompleksitet
I løbet af det sidste årti er cykliske peptider fremstået som en lovende klasse af terapeutiske midler, viser et bredt terapeutisk vindue, der spænder fra antifertilitet til antivirale og anticancer -applikationer. Mange monocykliske og bicykliske peptider er blevet identificeret, og antallet af cykliske peptider, der kommer ind i kliniske forsøg, er drastisk steget.
Ikke desto mindre, det er blevet klart, at der i nogle tilfælde er behov for mere strukturelt komplekse peptider for at nå passende aktivitetsniveauer. Vancomycin, det 'sidste udvej' tricykliske antibiotiske peptid, giver et illustrerende eksempel på en så kompleks konstruktion. Den alarmerende stigende resistens af bakterier mod aktuelt tilgængelige antibiotika kræver komplekse peptidkonstruktioner analogt med vancomycin.
Kredit:HIMS
Søgningen efter nye syntetiske veje til komplekse multicykliske peptider har således vundet alvorlig interesse. Tidligere rapporterede metoder til oprettelse af multicykliske peptider har været begrænset på grund af dannelse af flere isomere, besværlige reaktionsprotokoller eller begrænset strukturel mangfoldighed.
CLIPS kombineret med CuAAC
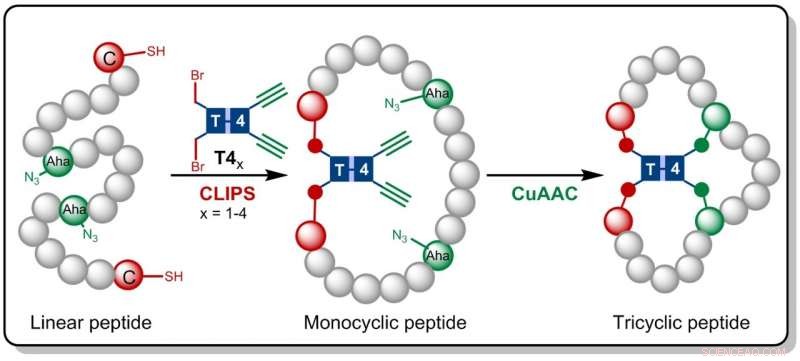
I forskningen nu offentliggjort i Angewandte Chemie , Amsterdam -kemikerne bygger på CLIPS -teknologien, der tidligere blev udviklet på Pepscan. Denne metode til 'kemisk indsprøjtning af peptider på stilladser' giver monocykliske og bicykliske peptider, der har vist sig at udvise forbedrede selektiviteter og affiniteter over for målproteiner.
Gaston Richelle har nu kombineret CLIPS -metoden med den fuldt kompatible CuAAC 'klik' kemi, hvilket fører til dannelsen af de komplekse tricykliske peptider. Ved at gøre brug af fleksible stilladsmolekyler, de eftertragtede tricykliske peptider dannes på en isomerisk ren måde. Den største fordel ved den nye metode er, at CLIPS- og CuAAC-reaktionerne kan udføres i en one-pot-procedure uden begrænsninger for arten og mængderne af aminosyrer, der implementeres i peptidsløjferne.
Som et resultat kan metoden anvendes i peptidbiblioteker med stor mangfoldighed for at generere en bred vifte af tricykliske topologier, der kan screenes for biologisk aktivitet. I øjeblikket udføres flere inhiberingsscreeninger, f.eks. mod enzymer, der er meget rigelige i kræftceller i første fase. Der udføres også nye antimikrobielle aktivitetsundersøgelser mod MRSA og Staphylococcus aureus. Tilføjelse til dette, forskergruppen undersøger i øjeblikket brugen af endnu mere komplekse T6-stilladser til at skabe penta- og hexacykliske peptider.
Sidste artikelMiNT -protein et nyt mål for at angribe sygdom
Næste artikelEn radikal tilgang til metanoxidation til methanol
 Varme artikler
Varme artikler
-
 Kemisk kompleks kan øge udskillelsen af radioaktivt strontium fra kroppenDer er en hypotese om, at M-InsP6 kunne forbedre elimineringen af radiostrontium. M-InsP6 kan binde radiostrontium, hæmmer absorption, og øge udskillelsen. Kredit:Kanazawa University 90 Sr (t1
Kemisk kompleks kan øge udskillelsen af radioaktivt strontium fra kroppenDer er en hypotese om, at M-InsP6 kunne forbedre elimineringen af radiostrontium. M-InsP6 kan binde radiostrontium, hæmmer absorption, og øge udskillelsen. Kredit:Kanazawa University 90 Sr (t1 -
 Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In
Fang energi fra sollys med farvestoffer inspireret af naturenDavid Moe Almenningen viser pigmentet, der kan forbedre solcellens ydeevne. Kredit:Vilde Bråten Mens sollys filtrerer gennem en skovkrone, klorofyl arbejder hårdt på at fange fotonernes energi. In -
 En opdateret forståelse af, hvordan man syntetiserer værdiskabende kemikalierKredit:CC0 Public Domain Forskere har længe været interesseret i at finde måder at bruge simple kulbrinter på, kemikalier lavet af et lille antal kulstof- og brintatomer, at skabe værdiskabende ke
En opdateret forståelse af, hvordan man syntetiserer værdiskabende kemikalierKredit:CC0 Public Domain Forskere har længe været interesseret i at finde måder at bruge simple kulbrinter på, kemikalier lavet af et lille antal kulstof- og brintatomer, at skabe værdiskabende ke -
 Forskerhold rekonstruerer motor-lastkompleks til ciliær transportDr. Zeynep Oekten og medforfatter Willi L. Stepp ved det fluorescensmikroskop, de bruger til at observere de motoriske proteiner, der løber langs mikrotubulierne (se video). Kredit:Andreas Battenberg
Forskerhold rekonstruerer motor-lastkompleks til ciliær transportDr. Zeynep Oekten og medforfatter Willi L. Stepp ved det fluorescensmikroskop, de bruger til at observere de motoriske proteiner, der løber langs mikrotubulierne (se video). Kredit:Andreas Battenberg


