MiNT -protein et nyt mål for at angribe sygdom
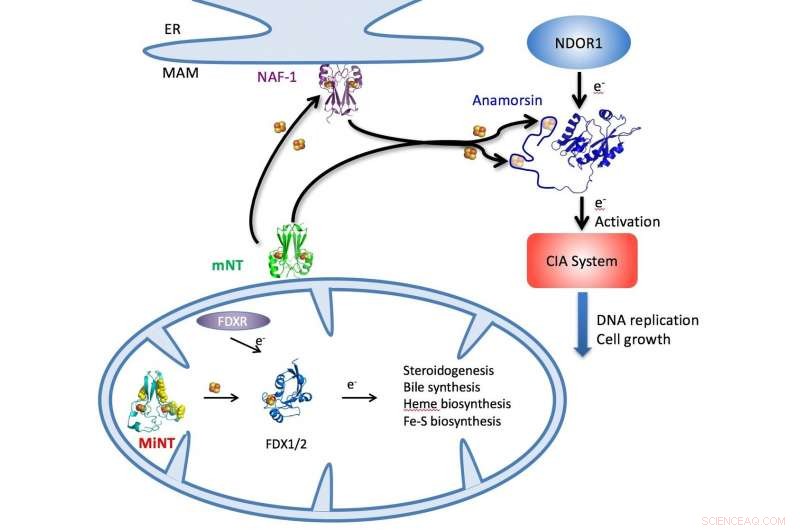
En illustration skitserer NEET-cyklussen i celler, hvormed jern-svovlklynger leveres af MiNT, mitoNEET (mNT) og NAF-1 proteiner i cytosolen eller mitokondrierne (bunden) til en række cellulære metaboliske processer, herunder syntese af ATP. Kredit:Patricia Jennings/University of California i San Diego
Et protein med to ansigter i en kæde, der regulerer jern og andre elementer i celler, kan give et nyt mål for behandling af kræft, diabetes og andre sygdomme.
Et team af forskere ved Rice University, University of California i San Diego (UCSD), Det hebraiske universitet i Jerusalem og University of North Texas detaljerede strukturen af et protein kaldet mitokondrielt indre NEET (MiNT), del af en vej, der stabiliserer mitokondrier, de organeller, der producerer energi til celler.
Deres rapport vises i denne uge i Procedurer fra National Academy of Sciences .
MiNT adskiller sig fra sine fætre, NEET-proteinerne mitoNEET og NAF-1, men de spiller alle en rolle i udviklingen af kræft, diabetes, neurodegenerative sygdomme og aldring. NEET -proteiner har været et fokus for teamet, der tidligere rapporterede deres betydning for binding af toksiske klynger af jern og svovl i celler og som et muligt mål for behandling af brystkræft.
I den nye undersøgelse, forskerne ledet af mangeårige samarbejdspartnere Patricia Jennings ved UCSD og José Onuchic ved Rices Center for Teoretisk Biologisk Fysik (CTBP) blev de første til at beskrive MiNTs krystallinske struktur, også kendt som CISD3, som ligger inde i mitokondrier.
Jennings og hendes team producerede den molekylære struktur. Med det, de var i stand til at vise, at mens MiNT deler nogle egenskaber med andre jern-svovlproteiner i NEET-familien, der er betydelige forskelle, der sandsynligvis gør den til den mest potente af de tre.
MitoNEET og NAF-1 (aka CISD1 og CISD2, henholdsvis) er dimerer, proteiner med to ens, forbundne monomerer, der findes i cytosolen, væsken inde i cellerne. Men MiNT er en monomer, der udelukkende lever inde i mitokondrier, hvor den samler jern-svovlklynger leveret af de andre NEET'er og distribuerer dem for at lette, blandt andet, syntesen af adenosintrifosfat (ATP), molekylet, der transporterer energi gennem cellerne for at muliggøre metaboliske processer.
MiNT adskiller sig også ved at vise to sider til sit miljø, den ene hydrofob (vandafvisende) og den anden hydrofil (vandtrækkende). "Fordi det er en monomer, hver side er forskellig, så det kommer til at interagere med forskellige proteiner, og du kan muligvis målrette den mod forskellige lægemidler på hver side, "sagde Jennings, en CTBP -tilknyttet og en professor i kemi og biokemi ved UCSD.
"Det er hurtigere og mere effektivt end de andre NEET'er, sagde Onuchic, hvis laboratorium byggede computersimuleringer for at studere MiNTs foldedynamik. ”Det ville være meget farligt at have et sådant protein i cytosolen;
derfor er det begrænset inde i mitokondrier, hvor der finder en masse bioenergetiske processer sted. "
Forskerne sagde, at MiNT er afgørende for balancen mellem jern og reaktive iltarter (ROS) i mitokondrier. "Jern er giftigt, "Sagde Jennings." For meget af det i cellen er dårligt. Vi skal derfor kontrollere det i vores kroppe, fordi det er så vigtigt for energiregulering og nøglen til sundhed og sygdom.
"Med strukturen i MiNT, vi kan begynde at forstå den komplette reguleringssløjfe, der styrer jern-svovlklynger og ROS, der ikke blev genkendt før, "sagde hun." Vi kan begynde at se, hvordan disse proteiner regulerer strømmen ind og ud af mitokondrierne. "
MiNTs rolle i ATP -produktion kan gøre det til et effektivt mål for krympende tumorer, Sagde Onuchic. Tidligere forsøg med de andre NEET'er viste nedregulering af deres udtryk eller målretning mod deres centre reducerede mængden af energi, der er tilgængelig for kræftceller, hvilket reducerer tumorvækst.
"Kræftceller har brug for så meget mere jern end raske celler med normal jernhomeostase, "sagde han." Når en celle deler sig, det skal fordoble ribosomerne, og det er energisk meget dyrt. Fordi kræftceller deler sig så hurtigt, de har brug for meget mere jern og er afhængige af NEET -cyklussen for at levere det.
"Kræft bruger de tre NEET -proteiner, fordi de kræver så meget jern og reaktivt ilt, "Onuchic sagde." Det, vi har bemærket - selvom det ikke er præcist, hvordan de fungerer - er, at hvis du slår nogen af dem ned, det får tumorer til at vokse mindre. Selvom du bare slår én ned, det reducerer kræftvækst. "Fordi MiNT er en mere vidunderlig producent af jern og ROS, det kan være den mest effektive af de tre at målrette mod, han sagde.
"Opdagelsen af MiNT -strukturen, dynamik og involvering i mitokondrielt jern og ROS -ophobning muliggjorde karakteriseringen af hele NEET humane proteinfamilien, "sagde medforfatter Rachel Nechushtai, professor ved det hebraiske universitet i Jerusalem. "I øvrigt, det giver vores internationale team den unikke mulighed for at opklare de tre NEET -proteiners indbyrdes sammenhænge og opdage, i hvilke cellulære veje de er involveret.
"Konstateringen af, at alle tre jern-svovlproteiner samarbejder i samme vej for at beskytte kræftceller, giver et glimrende sæt mål for kræftbehandling, " hun sagde.
"Den forbindelse, NEET -proteiner tilvejebringer mellem jernniveauer i kræftceller og niveauet af reaktive iltarter, demonstrerer, hvordan kræftceller styrer balancen mellem en høj spredning og mutationer, hvilket er nøglen til vores forståelse af, hvordan man bekæmper kræft, "sagde medforfatter Ron Mittler, professor i biologiske videnskaber ved University of North Texas.
 Varme artikler
Varme artikler
-
 Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelseIllustration af de anvendte matematiske transformationer, først på billedet af et skakbræt, derefter på mikrofluidiske multipoler. Kredit:Polytechnique Montréal og McGill University Professor Thom
Nye automatiserede biologiske prøveanalysesystemer til at fremskynde sygdomsopdagelseIllustration af de anvendte matematiske transformationer, først på billedet af et skakbræt, derefter på mikrofluidiske multipoler. Kredit:Polytechnique Montréal og McGill University Professor Thom -
 Ingeniører laver en simpel test, der kan måle stresshormoner i sved, blod, urin eller spytUniversity of Cincinnati forskningsassistent Shima Dalirirad undersøger en maskine, der udskriver teststrimler i UCs Nanoelectronics Laboratory. Kredit:Andrew Higley/UC Creative Services Stress ka
Ingeniører laver en simpel test, der kan måle stresshormoner i sved, blod, urin eller spytUniversity of Cincinnati forskningsassistent Shima Dalirirad undersøger en maskine, der udskriver teststrimler i UCs Nanoelectronics Laboratory. Kredit:Andrew Higley/UC Creative Services Stress ka -
 Lab forvandler fluorescerende mærker til kræftdrabereDesignet af thio-baserede fotosensibilisatorer, til venstre, af Rice University viser kemikere løfte om fotodynamisk kræftbehandling, blandt andre applikationer. En thiocarbonylsubstitution - handel m
Lab forvandler fluorescerende mærker til kræftdrabereDesignet af thio-baserede fotosensibilisatorer, til venstre, af Rice University viser kemikere løfte om fotodynamisk kræftbehandling, blandt andre applikationer. En thiocarbonylsubstitution - handel m -
 Virkningerne af surt vandSyrevand kan have visse usunde påvirkninger på mennesker, for det meste gennem absorption i lungerne, hvor de sure forbindelser kan forårsage skade. Der er også nogle synlighedsforstyrrelser forårsage
Virkningerne af surt vandSyrevand kan have visse usunde påvirkninger på mennesker, for det meste gennem absorption i lungerne, hvor de sure forbindelser kan forårsage skade. Der er også nogle synlighedsforstyrrelser forårsage
- Hvordan forbehandlingsmetoder påvirker omdannelseseffektiviteten af biomasseenergiproduktion
- En brugervenlig tilgang til aktiv belønningslæring i robotter
- Platin-grafen brændselscellekatalysatorer viser overlegen stabilitet i forhold til bulk platin
- Betydningen af lydbølger
- Større, dyrere iPhone vist ved Apple -arrangement onsdag
- Forskningshøjdepunkter skal sikre droner og robotbiler mod cyberangreb


