Forståelse af enzymkaskader er nøglen til forståelse af stofskifte
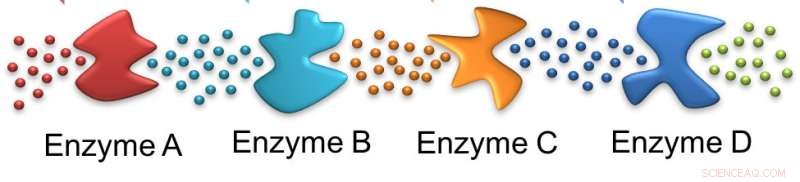
Ligesom myrer, et enzym følger sporet efterladt af det foregående. I dette tilfælde, det indledende substrat påvirkes af enzym A, efterlader et substrat, der er egnet til enzym B og på linjen. Kredit:Ayusman Sen, Penn State
En skefuld sukker kan få medicinen til at falde, men at forstå, hvad der sker med det sukker i cellen, er langt mere kompliceret end simpel fordøjelse, ifølge forskere. For at sukker kan metabolisere og levere energi til cellerne, en række enzymer - biologiske katalysatorer - skal hver, på tur, nedbryde en reaktant. I dette tilfælde, forskerne brugte glukose, sukkeret, der findes i majssirup og det ene af de to sukkerarter, der opstår, når bordsukker - saccharose - nedbrydes i kroppen.
I denne kaskade, det første enzym virker på glukosen, der leveres til cellen, og de efterfølgende enzymer virker på successive produkter. I processen, to adenosintrifosfatmolekyler - ATP - forbruges, men fire produceres. Hydrolysen af ATP driver mange cellulære processer til at opretholde cellens levedygtighed. Lignende enzymkaskader er ansvarlige for mange metaboliske processer i kroppen.
Enzymer, der deltager i sådanne reaktionsveje, har i nogle tilfælde vist sig at danne intracellulære, reversible komplekser betegnet metaboloner af Paul Srere (død), University of Texas Southwestern Medical School. At have enzymerne i nærheden af hinanden letter den række reaktioner, de katalyserer. Et sådant eksempel er purinosomet opdaget ved Evan Pugh University Professor og Eberly Chair i kemi Stephan J. Benkovic's Lab i Penn State, der består af seks enzymer involveret i biosyntesen af puriner.
Forskerne spurgte, om en af de faktorer, der bidrager til metabolondannelse, kan være en gradient af kemikalier, der genereres af de deltagende enzymer. De rapporterer deres resultater i dagens (18. december) nummer af Naturkemi .
"Vi opdagede for noget tid siden, at simple katalysatormolekyler som enzymer også vil kemotaxe op ad en reaktants gradient, "sagde Ayusman Sen, fornem professor i kemi, Penn State. "De bevæger sig mod højere og højere koncentrationer af reaktant."
Bevægelsen kaldes kemotaksi, hvor individuelle molekyler vandrer langs en koncentrationsgradient af andre molekyler.
"Alle levende ting kemotaxi, "sagde Sen." Hvis du er sulten og pludselig lugter pommes frites, du vil prøve at gå mod pommes frites. Hvis lugten falder, du vil tilfældigt vende dig for at prøve at finde den højere koncentration af fransk-steg lugtmolekyler, indtil du er ved fransk-stegetælleren. "
I deres undersøgelse, forskerne brugte kun de første fire enzymer i den glykolytiske vej - hexokinase, phosphoglucose -isomerase, phosphofructokinase og aldolase. Disse fire trin forbruger faktisk ATP. For at studere bevægelsen af enzymerne, forskerne brugte fluorescerende mærkning af hexokinase og aldolase, de første og fjerde enzymer i vejen. Hver blev mærket med et andet fluorescerende farvestof, så bevægelsen af begge enzymer kunne følges.
De så på tre tilfælde - den normale reaktion, hvor hexokinase phosphorylerer glucose; reaktionen af hexokinase med mannose, et sukker, der binder stærkere, men har en langsommere reaktionshastighed; og endelig med L-glucose, en form for glucose, der ikke bruges af hexokinase. Fosforyleringen kræver ATP. I nærvær af phosphoglucose -isomerase - det andet enzym - og phosphofructokinase - det tredje enzym - produceres reaktanten for aldolase.
Forskerne observerede, at aldolasen bevæger sig mod hexokinasen i deres strømningseksperiment, afslører, at aldolase kemotaxer reaktantgradienten produceret af funktionen af de tre første enzymer i vejen. Kemotaxien var størst med D-glucose, mindre med mannose og ikke observeret med L-glucose.
Teoretisk modellering af enzymbevægelsen forudsagde kvalitativt omfanget af enzymbevægelse.
Forskerne kiggede også på, om kemotaxi af enzymer ville forekomme i en model af det usædvanligt overfyldte intracellulære miljø. De tilføjede et stof med stor molekylvægt for at simulere en sådan trængsel. Kemotaksi forekom stadig, men i en langsommere hastighed.
"Chemotaxis langs en kemisk gradient kan være en faktor i samlingen af enzymklynger, såsom metaboloner, "sagde Benkovic." Andre faktorer, såsom ikke -kovalente interaktioner forventes stadig at bidrage. "
Opløsningen af forskningsinstrumentet, imidlertid, var utilstrækkelig til at demonstrere i dette tilfælde, at de fire enzymer samledes til et metabolon. Forskerne observerede dannelsen af store aggregater af enzymer, men kunne ikke påvise, at de fungerede metaboloner.
Sidste artikelSukkerovertrukket verden
Næste artikelMiNT -protein et nyt mål for at angribe sygdom
 Varme artikler
Varme artikler
-
 Nyt gennembrud åbner døre til behandling af melanin-relaterede hudsygdommeEn krystalstruktur af TYRP1. Tyrosin (substratet metaboliseret af TYPR1, i dyb farve) er bundet til det aktive sted, hvor zinkmetalionerne (røde kugler) koordinerer den funktionelle rolle. Kredit:Mont
Nyt gennembrud åbner døre til behandling af melanin-relaterede hudsygdommeEn krystalstruktur af TYRP1. Tyrosin (substratet metaboliseret af TYPR1, i dyb farve) er bundet til det aktive sted, hvor zinkmetalionerne (røde kugler) koordinerer den funktionelle rolle. Kredit:Mont -
 Brug af gennemsigtigt blæk til at udskrive farvebillederKredit:Pixabay/CC0 Public Domain Et team af forskere tilknyttet en lang række institutioner i Kina har udviklet en ny måde at printe farvebilleder på ved hjælp af standard inkjet-printere. I deres
Brug af gennemsigtigt blæk til at udskrive farvebillederKredit:Pixabay/CC0 Public Domain Et team af forskere tilknyttet en lang række institutioner i Kina har udviklet en ny måde at printe farvebilleder på ved hjælp af standard inkjet-printere. I deres -
 Ved at kopiere bakterielle enzymer, laboratoriet lærer hurtigt at syntetisere ny klasse af antibiot…Jordbakterien Pseudomonas fluorescens, her lyser stærkt under ultraviolet lys, udstråler et antibiotikum kaldet obafluorin, der har en ny ß-lactonstruktur. Kredit:Washington University i St. Louis
Ved at kopiere bakterielle enzymer, laboratoriet lærer hurtigt at syntetisere ny klasse af antibiot…Jordbakterien Pseudomonas fluorescens, her lyser stærkt under ultraviolet lys, udstråler et antibiotikum kaldet obafluorin, der har en ny ß-lactonstruktur. Kredit:Washington University i St. Louis -
 Diagnostisk platform kunne strække sig til at påvise biomarkører for sygdomZehra Parlak ser på sin proof-of-principle point-of-care diagnostiske enhed, grundlaget for hendes startup-firma kaldet Qatch. Kredit:Duke University Et startup-firma baseret på teknologi licenser
Diagnostisk platform kunne strække sig til at påvise biomarkører for sygdomZehra Parlak ser på sin proof-of-principle point-of-care diagnostiske enhed, grundlaget for hendes startup-firma kaldet Qatch. Kredit:Duke University Et startup-firma baseret på teknologi licenser
- Nysen og hoste fungerer som mini atombomber og overstiger regelmæssigt to meter
- Ny dobbeltkontrastteknik opfanger små tumorer på MR
- Kobber-nikkel nanotråde kunne passe perfekt til printbar elektronik
- Sidst på sommeren er arktisk havisudbredelse ottende lavest nogensinde
- Landformer i ferskvandsområder
- Minimering af virkningen af restaurantlukninger, restriktioner i Kina midt i COVID-19-krisen


