Nyt gennembrud åbner døre til behandling af melanin-relaterede hudsygdomme
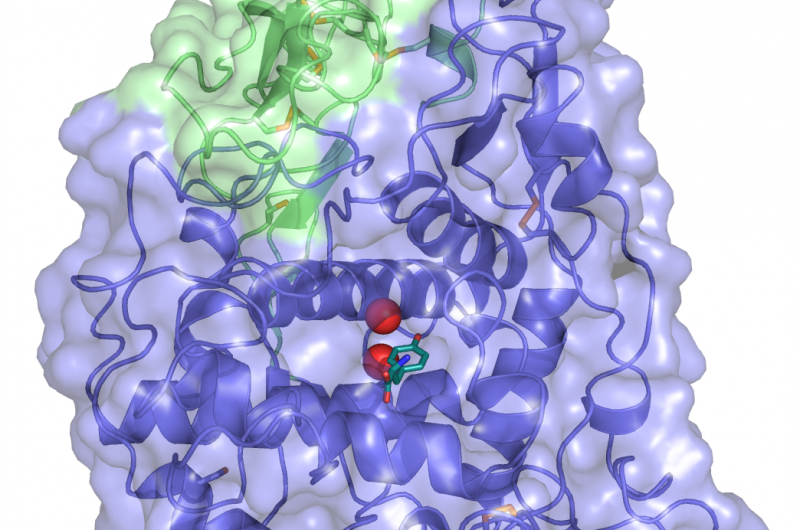
En krystalstruktur af TYRP1. Tyrosin (substratet metaboliseret af TYPR1, i dyb farve) er bundet til det aktive sted, hvor zinkmetalionerne (røde kugler) koordinerer den funktionelle rolle. Kredit:Montse Lopez
Nyt gennembrud åbner døre til behandling af melanin-relaterede hudsygdomme
Pletter som følge af for meget soleksponering og andre effekter af dysfunktionel melaninproduktion kan blive en saga blot. Forskere har løst strukturen af et af de tre enzymer, der genererer melanin hos mennesker, åbne døre til design af blegemidler for at fjerne misfarvninger af huden. Undersøgelsen blev offentliggjort i Angewandte Chemie
Sommer er ofte et synonym for folk, der slapper af på strandene og prøver at blive solbrune. Med alderen og hyppig udsættelse for solen, nogle mennesker kan få de såkaldte "alderpletter" eller "leverpletter", som er små mørke områder på huden. At slippe af med disse er en udfordring, og forskere og kosmetikindustrien forsøger at finde en måde at fjerne dem på på lang sigt.
Nu, et team af forskere fra ESRF, University of Groningen og Wageningen Food and Biobased Research (Holland) har netop dechifreret et af de tre enzymer, der genererer melanin, pigmentet, der giver huden, hår og øjne deres farve. Når disse enzymer ikke fungerer korrekt, skaber de pigmenteringsforstyrrelser:pletter på huden, albinisme eller melanom.
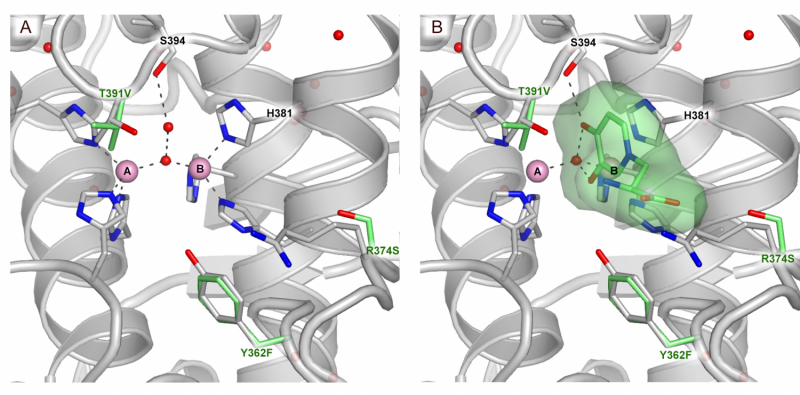
En substratbindingsmåde af TYRP1 aktivt sted. (A) Aktivt sted for TYRP1 (B) aktive sted for TYRP1 med bundet substrat. Kredit:@Montse lopez
Indtil i dag, strukturerne af disse tre enzymer var ukendte, så videnskabsmænd har brugt svampe- eller planteenzymer til at syntetisere forbindelser rettet mod mennesker. Udfordringen ved at løse disse strukturer ligger i det faktum, at forskerne ikke ved, hvordan disse enzymer arbejder for at producere melanin, og de har aldrig formået at rense den menneskelige version i store mængder for at studere dem.
Uventede fund
Xuelei Lai, første forfatter til undersøgelsen, fokuseret på menneskelige enzymer frem for planteenzymer. Han forklarer, at "vi har formået at oprense og krystallisere tyrosinase og tyrosinase-relateret protein 1 (TYRP1), og vi har løst strukturen af TYRP1. Dette er den første struktur, der er tilgængelig for et pattedyrs melanogent enzym. Vi tror, at hvis vi følger det samme. procedure kunne vi sandsynligvis løse strukturen af tyrosinase og tyrosinase-relateret protein 2, så disse resultater ser meget lovende ud i vores søgen efter at skille den komplekse måde melanin genereres ud på".
Forskere har også afsløret et uventet resultat:de har fundet ud af, at TYRP1 har brug for zink for at fungere, i modsætning til den etablerede tro i samfundet, at dette enzym har brug for kobber. "Vi ved stadig ikke præcis, hvilken rolle zink spiller i interaktionen med TYRP1, og vi har brug for omfattende yderligere forskning for at finde ud af det", forklarer Montse Soler López, tilsvarende forfatter til papiret og videnskabsmand ved ESRF.

Montse Soler Lopez, Kontaktforfatter, ESRF-forsker ved ESRF-laboratoriet. Kredit:@ESRF
Nøglen til dette arbejde er, at det giver en ægte model for design af blegemidler til at fjerne pletter, der opstår på folks hud på grund af solen eller alder. Bauke W. Dijkstra, også tilsvarende forfatter og tidligere forskningsdirektør ved ESRF, forklarer relevansen af deres arbejde i industriel sammenhæng:"Kosmetikvirksomheder investerer en kæmpe indsats i dette, så vi forventer, at vores resultater vil være et stort fremskridt på området."
 Varme artikler
Varme artikler
-
 At snyde den nye coronavirus med et falsk håndtrykTransmissionselektronmikrografi af SARS-CoV-2-viruspartikler, isoleret fra en patient. Billede taget og farveforbedret på NIAID Integrated Research Facility (IRF) i Fort Detrick, Maryland. Kredit:NIAI
At snyde den nye coronavirus med et falsk håndtrykTransmissionselektronmikrografi af SARS-CoV-2-viruspartikler, isoleret fra en patient. Billede taget og farveforbedret på NIAID Integrated Research Facility (IRF) i Fort Detrick, Maryland. Kredit:NIAI -
 Fuld af varm luft og stolt over det:Forbedring af gaslagring med MOF'erIdealiseret interpenetreret MOF -struktur. Den sammenfiltrede MOF kan sprede varme omtrent to gange hurtigere, end de bestanddele MOF kan separat, muligvis muliggør mere effektiv gaslagring. Kredit:Sw
Fuld af varm luft og stolt over det:Forbedring af gaslagring med MOF'erIdealiseret interpenetreret MOF -struktur. Den sammenfiltrede MOF kan sprede varme omtrent to gange hurtigere, end de bestanddele MOF kan separat, muligvis muliggør mere effektiv gaslagring. Kredit:Sw -
 Ny ramme anvender maskinlæring til atomistisk modelleringKredit:Pixabay/CC0 Public Domain Forskere fra Northwestern University har udviklet en ny ramme ved hjælp af maskinlæring, der forbedrer nøjagtigheden af interatomiske potentialer - de vejledende
Ny ramme anvender maskinlæring til atomistisk modelleringKredit:Pixabay/CC0 Public Domain Forskere fra Northwestern University har udviklet en ny ramme ved hjælp af maskinlæring, der forbedrer nøjagtigheden af interatomiske potentialer - de vejledende -
 Forskere syntetiserer vedvarende olier til brug i smøremidlerKredit:CC0 Public Domain Motor gear, fly thrustere, køleskabskompressorer, vindmøller - listen over vigtige industrimaskiner, landbrugsudstyr, transportfartøjer, og hjemmeapplikationer, der er afh
Forskere syntetiserer vedvarende olier til brug i smøremidlerKredit:CC0 Public Domain Motor gear, fly thrustere, køleskabskompressorer, vindmøller - listen over vigtige industrimaskiner, landbrugsudstyr, transportfartøjer, og hjemmeapplikationer, der er afh
- Frosset i tiden:Glacial arkæologi på Norges tag
- Sådan finder du terningroot i Ti-84
- Ejer du en cykel, du aldrig kører på? Vi skal lære at fejle bedre i aktiv transport
- Klik på e-handel kan forbinde forbrugere med deres årsager
- Sådan fungerer måneformørkelser
- Texas-tilsynsmyndigheder:Crypto-relaterede svindel bliver kreativ


