Undersøgelse af foldningsstabilitet og dynamik af proteiner
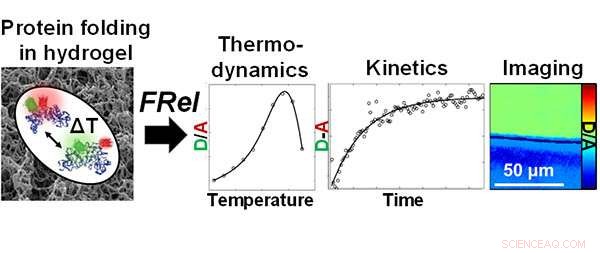
Forskere ved Beckman Institute ved University of Illinois brugte Fast Relaxation Imaging (FReI) til at undersøge foldningsstabiliteten og dynamikken af proteiner i polyacrylamidhydrogeler. Kredit:Lydia Kisley, Beckman Institut for Avanceret Videnskab og Teknologi
Hydrogeler er polymermaterialer, der kan absorbere en stor mængde vand, gør dem fleksible som menneskevæv. De bruges i en række medicinske anvendelser, inklusive kontaktlinser, sårforbindinger, og ansigtsrekonstruktion.
Hydrogeler kan også bruges til medicinafgivelse, for eksempel, som belægninger til lægemidler. Imidlertid, Der er stadig spørgsmål om effektiviteten af lægemiddelleveringen, da det ikke er klart, hvordan proteiner i din krop interagerer med hydrogelerne.
"Hvis du putter en hydrogel i din krop, der er proteiner i din krop, som derefter kan interagere med det materiale, " sagde Lydia Kisley, en Beckman-Brown tværfaglig postdoc. "Ideelt set ønsker man, at proteiner skal bevare deres funktion og deres struktur, så der er ingen negative virkninger."
Kisley, en kemiker, og andre forskere ved Beckman Institute for Advanced Science and Technology ved University of Illinois brugte for nylig Fast Relaxation Imaging (FReI) til at undersøge foldningsstabiliteten og dynamikken af proteiner i polyacrylamidhydrogeler. Deres resultater er offentliggjort i "Direct Imaging of Protein Stability and Folding Kinetics in Hydrogels" i ACS anvendte materialer og grænseflader .
"Vi forsøger at forstå, hvordan proteiner opfører sig i disse materielle miljøer, " sagde Kisley. "Der er ikke mange værktøjer til rådighed til at gøre det. Dette papir var den første demonstration af den nye billeddannelsesteknik til at forstå proteiner i et materiale."
Gruppen brugte et fluorescensmikroskop i Martin Greubeles laboratorium, en professor i kemi og medlem af Beckman's Nanoelectronics and Nanomaterials Group. FReI detekterer protein, der udfolder sig in situ ved at afbilde ændringer i fluorescensresonansenergioverførsel (FRET) efter temperaturspringsforstyrrelser.
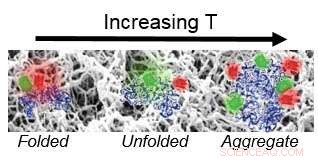
Brug af Fast Relaxation Imaging (FReI), forskere ved Beckman Institute for Advanced Science and Technology ved University of Illinois undersøgte foldningsstabiliteten og dynamikken af proteiner i polyacrylamidhydrogeler. Kredit:Lydia Kisley, Beckman Institut for Avanceret Videnskab og Teknologi
"Det unikke, som vi tilføjer her med mikroskopet, er en temperaturændring. Ved at bruge denne meget hurtige temperaturændring, vi kan fortælle, hvordan proteinet reagerer på temperaturen, og hvor stabilt det er. Og hvordan indeslutningen og kemien af hydrogelen også ændrer proteinstabiliteten, " sagde Kisley.
Proteinets funktion kommer fra, hvordan det er foldet, Kisley forklarede. For at forstå, hvordan proteiner, der udgør nogle lægemidler, fungerer, det er afgørende at forstå, hvordan de folder.
Gruppen fastslog, at hydrogelen øger proteinstabiliteten, fremskynder foldeafslapning, og fremmer irreversibel binding ved opløsning-gel-grænsefladen.
"Selvom disse materialer er meget kompatible, da de har højt vandindhold, vi fandt ud af, at ved lave temperaturer, når proteinet er udfoldet, er det okay, men når først proteinet begynder at udfolde sig en lille smule, vil det begynde at klæbe til materialet, og kan faktisk fremme flere proteiner til at aggregere og holde sig til det, så det tyder på, at proteinet er destabiliseret en smule, " sagde Kisley.
"Det var et mere kompliceret system, end vi havde forventet. Jeg troede, det ville være enkelt, men det er ret almindeligt i videnskaben, hvor tingene ender med at blive mere komplicerede, end du forventer."
Kisleys stipendium ved Beckman Institute har givet hende mulighed for at forbinde sin doktorgradsforskning i diffusion og adsorption af proteiner i hydrogeler til proteinfoldning i hydrogeler og yderligere overflade- og polymerbørsteprøver.
Hun planlægger at undersøge, om den adfærd, vi ser i en større 3D-gel, også sker på en mindre overflade, miljø i nanoskala.
 Varme artikler
Varme artikler
-
 Den japanske nobelpristager for kemi Shimomura dør, 90 år gammelI denne 7. dec. 2008, fil foto, Nobelpristageren i kemi Osamu Shimomura taler under pressekonferencen på Det Kongelige Svenske Videnskabsakademi i Stockholm. Sverige. Shimomura, en af tre forskere,
Den japanske nobelpristager for kemi Shimomura dør, 90 år gammelI denne 7. dec. 2008, fil foto, Nobelpristageren i kemi Osamu Shimomura taler under pressekonferencen på Det Kongelige Svenske Videnskabsakademi i Stockholm. Sverige. Shimomura, en af tre forskere, -
 Varmebehandling kan gøre kemoterapi mere effektivEn kunstners opfattelse af, at de doxorubicinfyldte nanokompositbærere internaliseres af celler (øverst) og forbliver udvendige celler (nederst), med en blodåre i midten. Kredit: Journal of Materials
Varmebehandling kan gøre kemoterapi mere effektivEn kunstners opfattelse af, at de doxorubicinfyldte nanokompositbærere internaliseres af celler (øverst) og forbliver udvendige celler (nederst), med en blodåre i midten. Kredit: Journal of Materials -
 Hvad er definitionen på opløsning i kemi?Du behøver ikke at være en gal videnskabsmand for at nyde kemi. Hver gang du drikker en sodavand, oplever du en sødet drikblanding opløst i kullsyreholdigt vand. Faststoffer, væsker og gasser kan alle
Hvad er definitionen på opløsning i kemi?Du behøver ikke at være en gal videnskabsmand for at nyde kemi. Hver gang du drikker en sodavand, oplever du en sødet drikblanding opløst i kullsyreholdigt vand. Faststoffer, væsker og gasser kan alle -
 Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
Brug af metaller til brændstofKredit:Pixabay/CC0 Public Domain Vidste du, at vi inden for mikrotyngdekraft forbereder et af de mest lovende brændstoffer til fremtiden? Mikrotyngdekraft hjælper med at finde svar og modeller ti
- Sådan rundes til nærmeste Tens
- Undersøgelse afslører ny trussel mod ozonlaget
- Eksotisk ny topologisk tilstand opdaget i Dirac -halvmetaller
- Ny forskning finder, at kulstofnanorør viser et kærligheds-/hadforhold til vand
- Hvordan er størrelserne på kugler,
- 3 USA-baserede økonomer vinder Nobel for forskning i løn, job


