Forskere opdager strukturen af anti-aging hormon
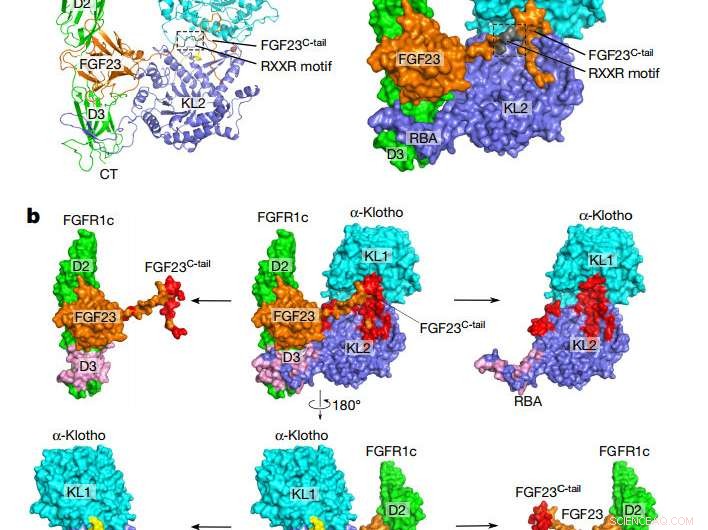
Overordnet topologi af FGF23-FGFR1cecto-α-klothoecto-komplekset. en, Tegneserie (venstre) og overfladerepræsentation (højre) af den ternære komplekse struktur. α-klotho KL1 (cyan) og KL2 (blå) domæner er forbundet med en kort prolinrig linker (gul; ikke synlig i overfladepræsentationen). FGF23 er i orange med sit proteolytiske spaltningsmotiv i gråt. FGFR1c er grønt. CT, C-terminal; NT, N endestation. b, Bindingsgrænseflader mellem α-klothoecto og FGF23-FGFR1cecto-komplekset. Det ternære kompleks (midten) er vist i to forskellige orienteringer relateret til en 180° rotation langs den lodrette akse. FGF23-α-klothoecto (rød) og FGFR1cecto-α-klothoecto (pink) grænseflader visualiseres ved at trække α-klothoecto og FGF23-FGFR1cecto komplekset væk fra hinanden. De adskilte komponenter er vist til venstre og højre for det ternære kompleks. Kredit: Natur (2018). DOI:10.1038/nature25010
En ny undersøgelse afslører den molekylære struktur af et protein kaldet alpha(α)Klotho, og hvordan det hjælper at overføre et hormonsignal, der bremser aldring.
Ledet af forskere fra NYU School of Medicine og offentliggjort online 17. januar i Natur , undersøgelsen afviser 20 års formodninger om, at αKlotho - opkaldt efter den græske gudinde, der spinder livets tråd - er et vigtigt anti-aldringshormon. I stedet tilskriver resultaterne denne funktion fibroblast vækstfaktor 23 (FGF23), og forklar, hvordan αKlotho simpelthen hjælper FGF23 med at formidle sin anti-aldringsvirkning.
Undersøgelser så langt tilbage som i 1997 havde vist, at mus, der var genetisk manipuleret til at mangle enten αKlotho eller FGF23, led af for tidlig aldring, herunder tidligt opstået hjerte-kar-sygdom, Kræft, og kognitiv tilbagegang. Ved at give et første kig på strukturen af den associerede gruppe af proteiner, der inkluderer FGF23, dets receptorprotein (FGFR), og αKlotho, den aktuelle undersøgelse omstøder dogmet om, at αKlotho alene fungerer som en levetidsfaktor.
"Ved at vise, at alle de måder, hvorpå αKlotho skulle beskytte organer, i stedet kommer fra dets evne til at hjælpe FGF23 med at signalere, vi har kastet nyt lys over den underliggende årsag til aldring, " siger hovedstudieforfatter Moosa Mohammadi, PhD, professor ved Institut for Biokemi og Molekylær Farmakologi ved NYU Langone Health. "Vores nye strukturelle data baner også vejen for design af nye midler, der enten kan tilskynde til eller blokere FGF23-αKlotho-signalering efter behov."
Struktur løser mysterium
For at bestemme atomstrukturen af FGF23-signalgruppen af proteiner, Mohammadi og kolleger brugte røntgenkrystallografi. Holdet lokkede først FGF23-hormonet, sammen med dets receptorprotein (FGFR) og αKlotho, at sætte sig ud af en opløsning og danne stakke af gentagne, ordnede krystaller. De udsatte derefter krystallerne for røntgenstråler, og brugte de reflekterede mønstre til at beregne proteinernes atomare struktur.
Den nye undersøgelse giver det første bevis på, hvordan FGF23 kun kan signalere til celler ved at danne et kompleks med αKlotho, dens receptor, og en anden partner i heparansulfat. Lavet af knogleceller, FGF23-hormonet er kendt for at rejse via blodbanen til celler i andre organer, hvor den leverer sit budskab ved at docke på og tænde for sin receptor. Den nyligt løste komplekse struktur afslører, hvordan αKlotho binder FGF23 til sin receptor med tilstrækkelig vedholdenhed til at aktivere den.
Undersøgelsen kaster også nyt lys over, hvordan nyresygdom fører til en unormal fortykkelse af hjertemuskelvæv kaldet hypertrofi. Hjertehypertrofi er en førende dødsårsag hos mennesker med beskadigede nyretubuli, forårsaget (for eksempel) af forhøjet blodtryk og diabetes. Når beskadigede nyretubuli ikke længere tilstrækkeligt kan fjerne fosfat i urinen, FGF23 stiger i et forsøg på at holde blodfosfat i skak, dels ved at kontrollere niveauerne af vitamin D. En fremherskende hypotese har været, at meget høje niveauer af FGF23 forårsager hypertrofi i hjertet, men teorien forblev kontroversiel, fordi hjertevæv ikke har αKlotho, som skal være til stede, hvis FGF23 skal signalere.
Tidligere undersøgelser havde vist, at den bedst kendte form for αKlotho er immobil, at være bundet til overflademembranerne af celler i nyretubuli, biskjoldbruskkirtlen, og visse områder af hjernen. Så fandt forskere ud af, at en del af αKlotho-proteinet, der stikker ud fra celleoverflader, ecto domænet, kan skæres af og udskilles i cirkulerende kropsvæsker, og derfor kan nå hjertet. Tidlige beviser, imidlertid, antydede, at fældet αKlotho ikke var i stand til at fungere som en FGF23-co-receptor. Den nye undersøgelse integrerer disse observationer ved at vise, at cirkulerende αKlotho faktisk kan fungere ligesom dens membranbundne form for at muliggøre FGF23-signalering.
Forskerne siger, at deres resultater vil starte endnu et lægemiddeludviklingsløb i nyresygdom. Mohammadi havde allerede vist, at en nøgledel af FGF23-hormonet (dets C-terminale halepeptid), når det injiceres i mus, konkurrerer med intakt FGF23 for at reducere dets signal og forhindre hjertehypertrofi. Ud over, holdet er allerede ved at designe nye molekyler, der ændrer FGF23/shed αKlotho-signalet baseret på de nyopdagede proteinstrukturer.
Undersøgelsen tyder også på, at et beslægtet protein, beta-Klotho, fungerer som den samme slags co-receptor for at hjælpe FGF21, et hormon relateret til FGF23. FGF21 fungerer ved at sende signaler, der holder blodsukker og fedtsyrer i balance, med konsekvenser for diabetes og fedme.
 Varme artikler
Varme artikler
-
 Fleksibelt termoelektrisk generatormodul:en sølvkugle til at løse problemer med spildenergiFigur 1. Foto og skematisk design af FlexTEG-modulet, foto af Bismuth-telluride (Bi-Te) halvlederchips, og spænding og effekt som funktion af strømmen for FlexTEG-modulet ved forskellige temperaturgra
Fleksibelt termoelektrisk generatormodul:en sølvkugle til at løse problemer med spildenergiFigur 1. Foto og skematisk design af FlexTEG-modulet, foto af Bismuth-telluride (Bi-Te) halvlederchips, og spænding og effekt som funktion af strømmen for FlexTEG-modulet ved forskellige temperaturgra -
 En sølvkugle til kemisk omdannelse af kuldioxidForskere opdager et overraskende første trin i den kemiske transformation af kuldioxid ved hjælp af en sølvkatalysator. Kredit:Berkeley Lab Fossile brændstoffer er livsnerven i moderne samfund, me
En sølvkugle til kemisk omdannelse af kuldioxidForskere opdager et overraskende første trin i den kemiske transformation af kuldioxid ved hjælp af en sølvkatalysator. Kredit:Berkeley Lab Fossile brændstoffer er livsnerven i moderne samfund, me -
 Hvordan er en vandmolekyle som en magnet?Hvis du var i stand til at se et vandmolekyle (H 2O) på nært hold, ville det se noget ud som et rundt hoved med to ører placeret ved 10 og 2 kl. Tænk på Mickey Mouse. Ørene er de to hydrogenioner,
Hvordan er en vandmolekyle som en magnet?Hvis du var i stand til at se et vandmolekyle (H 2O) på nært hold, ville det se noget ud som et rundt hoved med to ører placeret ved 10 og 2 kl. Tænk på Mickey Mouse. Ørene er de to hydrogenioner, -
 Det tosprogede molekyle forbinder to grundlæggende koder for livetDet nye molekyle rummer potentialet for forskellige biomedicinske anvendelser, siger Emory -kemiker Jennifer Heemstra (til højre), seniorforfatter af papiret. Hun vises i sit laboratorium med kandidat
Det tosprogede molekyle forbinder to grundlæggende koder for livetDet nye molekyle rummer potentialet for forskellige biomedicinske anvendelser, siger Emory -kemiker Jennifer Heemstra (til højre), seniorforfatter af papiret. Hun vises i sit laboratorium med kandidat
- DNA-stregkodningsteknologi, der hjælper med at overvåge sundheden for altafgørende boreale skove
- Nøgleplantearter kan være vigtige for at understøtte wildflower -bestøvere
- Hvornår begyndte mennesker at eksperimentere med alkohol og stoffer?
- Hemmeligheder bag fluorescerende mikroalger kan føre til supereffektive solceller
- USA er officielt tilbage i Paris-aftalen, løfter klimaindsats
- Telecom Italias administrerende direktør træder tilbage, hvis hedgefonden bryder bestyrelsen op:ra…


