Cellulær genbrug taget på fersk gerning
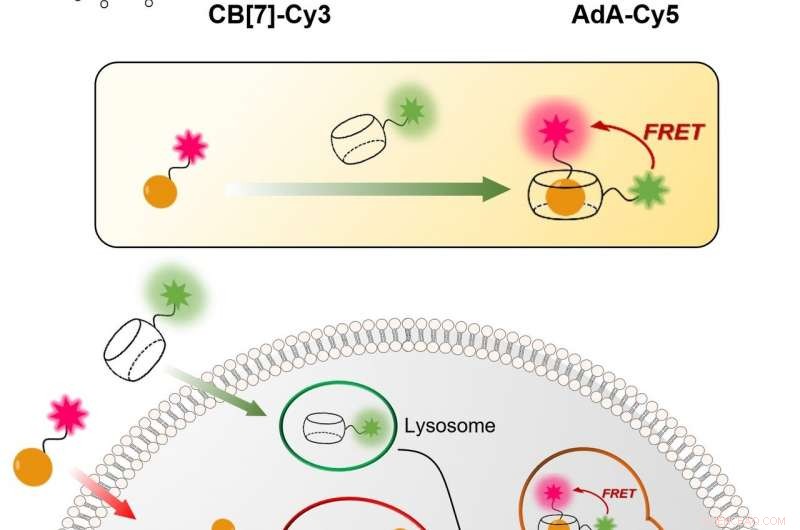
Figur 1:Relativt simpel og billig teknik til at visualisere den cellulære genbrugsmekanisme (autofagi) i realtid. Processen er baseret på bindingen mellem CB [7] og AdA. CB[7] er bundet til det fluorescerende farvestof Cy3 (farvet i grønt) og kommer ind i lysosomerne, mens AdA er bundet til det fluorescerende Cy5 (farvet i rødt), som akkumuleres i mitokondrier. I autofagi-processen, de to cellulære organeller smelter sammen, førte til mødet mellem CB[7] og AdA. Forskerne kan opdage fusionen, fordi når de to fluorescerende farvestoffer rykker tættere på, de interagerer med hinanden via fluorescensresonansenergioverførselsmekanismen (FRET). På denne måde forskerholdet kan analysere autofagi-processen trin for trin. Kredit:Institut for Grundvidenskab
Et team af forskere ved Center for Selvsamling og kompleksitet, inden for Institute for Basic Science (IBS) har observeret en normal fysiologisk proces, kaldet "selvspisning", som celler bruger til at genbruge deres komponenter. De udviklede en præcis teknik, der visualiserer, hvordan mitokondrier, cellernes energifabrikker, er fusioneret med lysosomer, cellers genbrugsmaskiner, for at få materiale destrueret og genbrugt. Da uregelmæssigheder i denne mekanisme kan føre til Alzheimers, Parkinsons, og andre komplikationer denne forskning kan hjælpe fremtidige fremskridt inden for diagnosticering af degenerativ hjernesygdom og udvikling af lægemidler. Undersøgelsen blev offentliggjort i Angewandte Chemie International Edition .
Navnet "autofagi" kommer fra det græske sprog og betyder "selvspisende". Lige så underligt det lyder, det er en uundværlig proces, der bruges til at rense celler fra beskadigede organeller og proteiner. Inde i lysosomer, gamle celledele nedbrydes til deres byggesten, som er ansat til at bygge nyt. For nylig, autofagi blev et meget aktivt studieområde og var i centrum for Yoshinori Ohsumis Nobelpris i fysiologi eller medicin i 2016.
Et eksempel på cellulær organel, der periodisk skal genbruges, er mitokondrien. Den omhyggelige regulering af denne proces er afgørende, og celler, der ikke deler sig regelmæssigt, som nerveceller, er særligt sårbare. Hvis celler akkumulerer defekte mitokondrier, de kan skade sig selv. Dette sker, for eksempel, ved Alzheimers og Parkinsons sygdomme, hvor opbygning af beskadigede mitokondrier og aggregerede proteiner fører til neuronal død.
Det er kendt, at autofagi (eller mitofagi, i det specifikke tilfælde af mitokondrier) sker ved fusion af to forskellige organeller, i dette tilfælde:mitokondrier og lysosomer. Imidlertid, at observere adfærden og fusionen af mitokondrier og lysosomer inde i cellerne har været udfordrende. Til dato, de fleste af disse undersøgelser er afhængige af fluorescerende proteiner knyttet til en organel, hvilket gør det muligt for forskerne kun at observere et organel ad gangen. I øvrigt, fluorescerende proteiner selv nedbrydes under autofagi, gør det vanskeligt at studere mekanismen nøjagtigt.
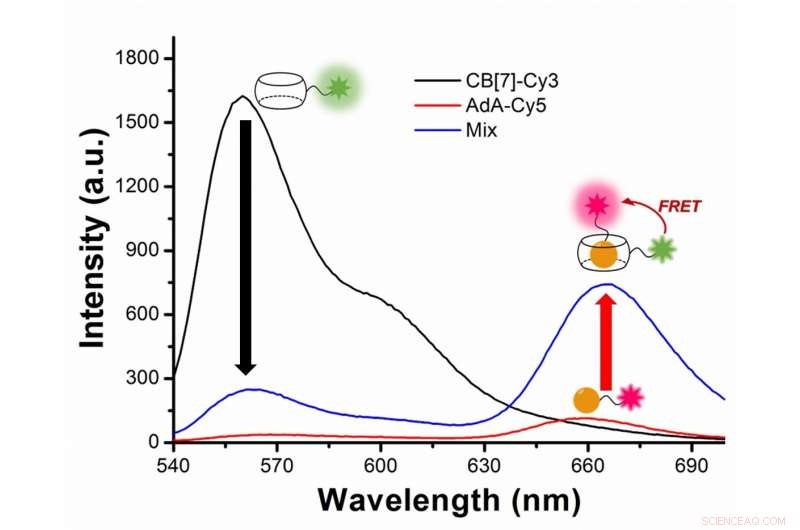
Figur 2:Undersøgelse af autofagi med fluorescensresonansenergioverførsel (FRET) mellem det grønlige fluorescerende farvestof Cy3 og det røde fluorescerende farvestof Cy5. Cy3 udsender fluorescens med en maksimal bølgelængde ved 563 nanometer (sort linje), mens Cy5 ved 670 nanometer (rød linje). I forsøget Cy3 er knyttet til CB[7] og Cy5 til AdA. Under autofagi, de to farvestoffer kommer tættere på, og Cy3 overfører noget energi til dets nærliggende partnerfarvestof Cy5, efter FRET-fænomenet. Forskerne fanger mødet mellem de to farvestoffer som en stigning i fluorescens med bølgelængde 644-800 nanometer (blå linje). Kredit:Institut for Grundvidenskab
IBS-forskere ved POSTECH udtænkte en kvantitativ procedure til at visualisere både mitokondrier og lysosomer over tid. Den relativt enkle og billige teknik er mere præcis end den nuværende. Den bruger hule tøndeformede syntetiske molekyler, kendt som cucurbituril (CB[7]), der binder med usædvanligt høj bindingsstyrke til et molekyle kaldet adamantylamin (AdA) og kan ikke nedbrydes af lysosomerne. CB[7] blev dekoreret med et fluorescerende farvestof (Cy3), mens AdA med et andet farvestof (Cy5). I første omgang, CB [7] -Cy3 kommer ind i lysosomerne og Ada-Cy5 i mitokondrierne, og så, når de to organeller smelter sammen i genbrugsprocessen, CB [7] -Cy3 og Ada-Cy5 binder sammen. På denne måde forskergruppen fulgte forskellige organelles adfærd og observerede mitofagiprocessen i levende celler. I øvrigt, forsøgene viste, at de to forbindelser ikke er toksiske for cellerne under en 800 nanomolær dosis.
"Den mest udfordrende del af eksperimentet var valget af kemikalierne. Vi valgte kemikalier med den rigtige hydrofilicitet, oplade, og molekylær størrelse til at blive selektivt inkorporeret i mitokondrier og lysosomer, " forklarer PARK Kyeng Min, en af de tilsvarende forfattere til undersøgelsen.
Mere teknisk set, nyheden i dette papir bygger på anvendelsen af fluorescensresonansenergioverførsel (FRET) til studiet af autofagi. FRET er en afstandsafhængig overførsel af energi mellem to forskellige fluorescerende farvestoffer; i dette tilfælde Cy3 og Cy5. Når de to er tæt nok på, Cy3 donerer energi til Cy5. Forskerne fanger mødet mellem de to farvestoffer, da overførslen af energi fra Cy3 til Cy5 fører til en reduktion i Cy3-fluorescensintensiteten til fordel for en stigning i Cy5-emissionsintensiteten.
I fremtiden, en lignende teknik kunne bruges til at studere autofagi processer, der involverer andre cellulære organeller, ligesom proteinfabrikkerne Golgi-apparat og endoplasmatisk retikulum.
 Varme artikler
Varme artikler
-
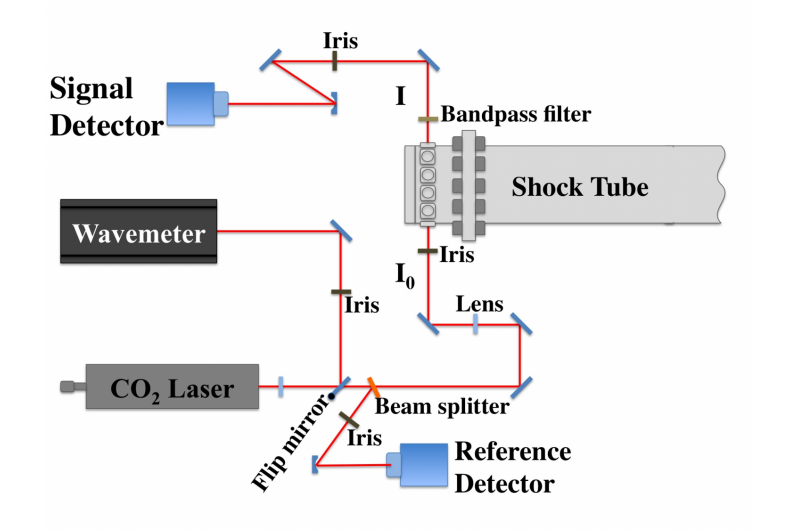 Giver en renere forbrændingNedbrydningen af DEC blev evalueret ved hjælp af en laserstråle, der passerede gennem et kompliceret system af spejle og linser (nederst), før den nåede stødrøret (øverst til venstre). Kredit:© 2017
Giver en renere forbrændingNedbrydningen af DEC blev evalueret ved hjælp af en laserstråle, der passerede gennem et kompliceret system af spejle og linser (nederst), før den nåede stødrøret (øverst til venstre). Kredit:© 2017 -
 Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskereKredit:CC0 Public Domain Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struk
Studer polyfarmakologi tidligere i lægemiddelopdagelsen, siger forskereKredit:CC0 Public Domain Polyfarmakologi - et lægemiddels evne til at påvirke mere end ét protein - bør studeres tidligt i lægemiddelopdagelsesforløbet, og konstant overvåget, da den kemiske struk -
 Lysere fleksibel elektroluminescerende film ved at adoptere øjenstruktur fra natlige dyrStruktur og karakteristika af elektroluminescerende anordning ved hjælp af rekursiv reflektionsstruktur. Strukturer (a~e) og betragtningsvinkelkarakteristika (f) af en elektroluminescerende enhed, der
Lysere fleksibel elektroluminescerende film ved at adoptere øjenstruktur fra natlige dyrStruktur og karakteristika af elektroluminescerende anordning ved hjælp af rekursiv reflektionsstruktur. Strukturer (a~e) og betragtningsvinkelkarakteristika (f) af en elektroluminescerende enhed, der -
 Ny forskning giver udvidet indsigt i hjernens reaktion på opioiderKredit:CC0 Public Domain Opioider er stærke smertestillende midler, der virker på hjernen, men de har en række skadelige bivirkninger, herunder afhængighed. Forskere fra Max Planck Institute of Bi
Ny forskning giver udvidet indsigt i hjernens reaktion på opioiderKredit:CC0 Public Domain Opioider er stærke smertestillende midler, der virker på hjernen, men de har en række skadelige bivirkninger, herunder afhængighed. Forskere fra Max Planck Institute of Bi
- Hvad er forskellen mellem månekalenderen og solkalenderen?
- Ny sanseteknologi kan hjælpe med at opdage sygdomme, svigagtig kunst, kemiske våben
- Vi har haft en smag af forstyrrede madforsyninger:Her er 5 måder, hvorpå vi kan undgå en gentagel…
- Hvordan temperatur og fugtighed hænger sammen
- Sådan beregnes procentandel mellem to tal
- Hvor kommer gas fra Amerika?


