Forskere skaber komplekse transmembrane proteiner fra bunden
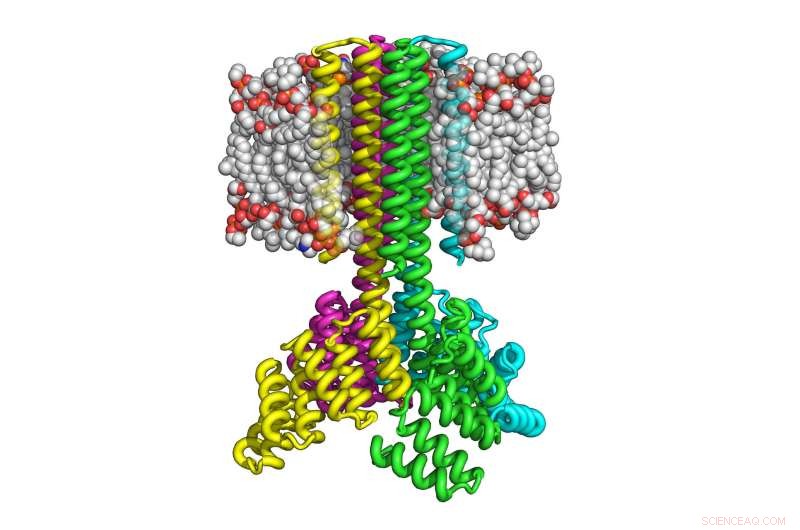
Denne illustration viser, hvordan fire kopier af computerdesignet transmembranprotein blev samlet til en raketformet tetramer med en bred cytoplasmatisk base, der trænger ind i otte transmembrane helixer, og som orienteres korrekt i membranen. Kredit:University of Washington Institute for Protein Design
Det er nu muligt at skabe komplekse, specialdesignede transmembranproteiner fra bunden, forskere rapporterer i denne uge. Forskuddet, ledet af molekylære ingeniører ved University of Washington Institute for Protein Design, vil gøre det muligt for forskere at oprette transmembrane proteiner, der ikke findes i naturen, til at udføre specifikke opgaver.
I den levende verden, transmembrane proteiner findes indlejret i membranen af alle celler og cellulære organeller. De er afgørende for, at de fungerer normalt. For eksempel, mange naturligt forekommende transmembranproteiner fungerer som gateways for bevægelse af specifikke stoffer hen over en biologisk membran. Nogle transmembrane proteiner modtager eller transmitterer cellesignaler. På grund af sådanne roller, mange lægemidler er designet til at målrette transmembrane proteiner og ændre deres funktion.
"Vores resultater baner vejen for design af multispan -membranproteiner, der kan efterligne proteiner, der findes i naturen eller have en helt ny struktur, funktion og anvendelser, "sagde David Baker, en professor i biokemi ved University of Washington School of Medicine og direktør for UW Institute of Protein Design, der ledede projektet. Forskningen er rapporteret i tidsskriftet 1. marts Videnskab . Peilong Lu, en senior i Baker -laboratoriet, er papirets hovedforfatter.
Men at forstå, hvordan transmembrane proteiner sættes sammen, og hvordan de fungerer, har vist sig at være udfordrende. Fordi de virker, mens de er indlejret i cellemembranen, transmembranproteiner har vist sig at være vanskeligere at studere end proteiner, der fungerer i den vandige opløsning, der udgør cellernes cytoplasma eller i den ekstracellulære væske.
I den nye undersøgelse, Lu og hans kolleger brugte et computerprogram, udviklet i Baker -laboratoriet og kaldet Rosetta, der kan forudsige strukturen, et protein vil folde ind i, efter at det er blevet syntetiseret. Et proteins arkitektur er afgørende, fordi et proteins struktur bestemmer dets funktion.
Et proteins form dannes fra komplekse interaktioner mellem aminosyrerne, der udgør proteinkæden og mellem aminosyrerne og det omgivende miljø. Ultimativt, proteinet antager den form, der bedst afbalancerer alle disse faktorer, så proteinet opnår den lavest mulige energitilstand.
Rosetta -programmet, der bruges af Lu og hans kolleger, kan forudsige et proteins struktur ved at tage hensyn til disse interaktioner og beregne den laveste samlede energitilstand. Det er ikke usædvanligt, at programmet opretter titusinder af modelstrukturer til en aminosyresekvens og derefter identificerer dem med lavest energitilstand. De resulterende modeller har vist sig nøjagtigt at repræsentere den struktur, sekvensen sandsynligvis vil antage i naturen.
Det er svært at bestemme strukturen af transmembranproteiner, fordi dele af transmembranproteiner skal passere gennem membranens indre, som er lavet af oliefedt kaldet lipider.
I vandige væsker, aminosyrerester, der har polære sidekæder - komponenter, der kan have en ladning under visse fysiologiske forhold, eller som deltager i hydrogenbinding - har en tendens til at være placeret på overfladen af proteinet, hvor de kan interagere med vand, som har negativt og positivt sideladninger til sit molekyle. Som resultat, polære rester på proteiner kaldes hydrofile, eller "vandelskende".
Ikke-polære rester, på den anden side, har en tendens til at blive fundet pakket inde i proteinkernen væk fra den polære vandige væske. Sådanne rester kaldes hydrofobe eller "vandfrygtige". Som resultat, interaktionen mellem de vandelskende og vandfrygtige rester af proteinet og de omgivende vandige væsker hjælper med at drive proteinfoldning og stabiliserer proteinets endelige struktur.
I membraner, imidlertid, proteinfoldning er mere kompliceret, fordi membranets lipidindretning er upolær, det er, det har ingen adskillelse af elektriske ladninger. Dette betyder, at proteinet skal være upolært, for at være stabilt vandfrygtige rester på overfladen, og pak dens polar, vandglade rester indeni. Derefter må den finde en måde at stabilisere sin struktur ved at skabe bindinger mellem de hydrofile rester i kernen.
Nøglen til at løse problemet, siger Lu, skulle anvende en metode udviklet af Baker lab til at designe proteiner, så de polære, hydrofile rester passer på en sådan måde, at nok ville danne polar-polære interaktioner, der kan binde proteinet indefra.
"At sammensætte disse 'begravede brintbindingsnetværk' var som at sammensætte et puslespil, "Sagde Baker.
Med denne tilgang, Lu og hans kolleger var i stand til at fremstille de designede transmembrane proteiner inde i bakterier og pattedyrsceller ved at bruge hele 215 aminosyrer. De resulterende proteiner viste sig at være meget termisk stabile og i stand til korrekt at orientere sig på membranen. Ligesom naturligt forekommende transmembrane proteiner, proteiner er flerpas, hvilket betyder at de krydser membranen flere gange, og samles i stabile multiproteinkomplekser, såsom dimerer, trimerer og tetramerer.
"Vi har vist, at det nu er muligt at designe komplekse nøjagtigt, multipass transmembrane proteiner, der kan udtrykkes i celler. Dette vil gøre det muligt for forskere at designe transmembrane proteiner med helt nye strukturer og funktioner, "sagde Lu.
Sidste artikelHoldbare træsvampe fungerer som grønne sensorer for mekanisk belastning
Næste artikelOmdannelse af CO2 til brugbar energi
 Varme artikler
Varme artikler
-
 Plastmarkederne tilpasser sig i en alder af COVID-193D-print af et piggprotein af SARS-CoV-2, virussen, der forårsager COVID-19-foran et 3D-print af en SARS-CoV-2-viruspartikel. Spike -proteinet (forgrunden) gør det muligt for virussen at komme ind og
Plastmarkederne tilpasser sig i en alder af COVID-193D-print af et piggprotein af SARS-CoV-2, virussen, der forårsager COVID-19-foran et 3D-print af en SARS-CoV-2-viruspartikel. Spike -proteinet (forgrunden) gør det muligt for virussen at komme ind og -
 Hvordan gode metaller bliver dårlige:Discovery forklarer uventede egenskaber ved eksotiske metallis…Kredit:Vienna University of Technology Nye målinger har løst et mysterium inden for faststoffysik:Hvordan kan det være, at visse metaller ikke ser ud til at overholde de gældende regler? Metaller
Hvordan gode metaller bliver dårlige:Discovery forklarer uventede egenskaber ved eksotiske metallis…Kredit:Vienna University of Technology Nye målinger har løst et mysterium inden for faststoffysik:Hvordan kan det være, at visse metaller ikke ser ud til at overholde de gældende regler? Metaller -
 Hvordan bliver et objekt positivt ladet?Har du nogensinde set et lynnedslag eller blevet chokeret, da du rørte ved en dørknop? I så fald har du observeret strømmen af elektriske ladninger i aktion. Positive og negative elektriske ladninge
Hvordan bliver et objekt positivt ladet?Har du nogensinde set et lynnedslag eller blevet chokeret, da du rørte ved en dørknop? I så fald har du observeret strømmen af elektriske ladninger i aktion. Positive og negative elektriske ladninge -
 Ved hjælp af DNA -tråde til at designe nye polymermaterialerForskere fra McGill University har kemisk præget polymerpartikler med DNA-strenge - en teknik, der kan føre til nye materialer til anvendelser lige fra biomedicin til det lovende område blød robottekn
Ved hjælp af DNA -tråde til at designe nye polymermaterialerForskere fra McGill University har kemisk præget polymerpartikler med DNA-strenge - en teknik, der kan føre til nye materialer til anvendelser lige fra biomedicin til det lovende område blød robottekn
- Houston, vi har haft et problem:at huske Apollo 13 på 50
- Vodafone køber en del af Libertys europæiske aktiver for 18,4 milliarder euro
- Virusoverflader hjælper ingeniører med at studere vaccine- og genterapiapplikationer
- Fysikeren foreslår, at kvanteskum kan bortforklare enorm kosmisk energi
- Undersøgelse:Liberal asyl- og flygtningepolitik reducerer ikke den indre sikkerhed, øge voldskrimi…
- Mikrofluidisk anordning simulerer kræftbehandling lige så effektivt som forskningsdyr


