Studiet giver mere end en million nye cykliske forbindelser, nogle med farmaceutisk potentiale

University of Illinois kemiprofessor Wilfred van der Donk og hans kolleger udviklede en ny metode til at generere store biblioteker af unikke cykliske forbindelser. Kredit:Don Hamerman
Forskere siger, at de nu kan producere et stort bibliotek af unikke cykliske forbindelser, nogle med kapacitet til at afbryde specifikke protein-protein-interaktioner, der spiller en rolle i sygdom. De nye forbindelser har cykliske strukturer, der giver dem stabilitet og forbedrer deres evne til at binde sig til deres mål.
Studiet, rapporteret i journalen Naturens kemiske biologi , afslørede også, at en af de nyligt genererede forbindelser interfererer med bindingen af et HIV-protein til et humant protein, en interaktion, der er afgørende for virussens livscyklus.
De fleste lægemiddelopdagelsesindsatser fokuserer på sygdomsfremkaldende interaktioner i enzymer og proteiner, der involverer klassiske "lås-og-nøgle"-mekanismer, sagde University of Illinois kemiprofessor Wilfred van der Donk, en Howard Hughes Medical Institute Investigator, der ledede undersøgelsen sammen med University of Southampton, professor i kemisk biologi, Ali Tavassoli. "I de fleste tilfælde, små kemiske lægemidler binder til hulrum i enzymer, hvor de kemiske reaktioner finder sted. Ved at binde til disse sprækker, stofferne forhindrer enzymerne i at virke."
Imidlertid, mange sygdomsprocesser involverer protein-protein-interaktioner, der ikke passer til denne model, sagde van der Donk.
"Disse har længe været betragtet som udfordrende, fordi de ikke involverer sådanne hulrum. Disse protein-protein-interaktioner består ofte af udvidede overflader, som kan være svære at hæmme med små molekyler, " han sagde.
Lineære peptider er også problematiske. De kan være "floppy, som spaghetti, og er derfor det meste af tiden i forkerte retninger til at binde, " sagde van der Donk. Cykliske molekyler sammensat af en eller flere ringe af aminosyrer er mere stabile og mindre modtagelige for cellulære enzymer, der har tendens til at tygge enderne af lineære peptider. De er derfor mere tilbøjelige til at binde sig til deres mål.
I den nye undersøgelse, van der Donk og hans kolleger gjorde brug af et enzym, de opdagede fra en bakterie, der lever i havet.
"Dette enzyms naturlige rolle er at lave omkring 30 forskellige cykliske proteiner, og vi testede, om det kunne lave analoger af disse naturlige produkter i Escherichia coli, " sagde van der Donk. E coli har været brugt som lægemiddelproducerende fabrik for farmaceutiske produkter.
De genetiske sekvenser indsat i E coli alle kodet for en række aminosyrer, der genkendes af enzymet. Ved tilfældigt at tilføje specifikke aminosyrer til denne "ledersekvens, "holdet var i stand til at generere et bibliotek med mere end en million unikke multicykliske proteiner.
Tavassoli og hans kolleger screenede derefter dette bibliotek i gensplejsning E coli for proteiner, der kunne afbryde bindingen af HIV-proteinet til dets humane værtscellemål.
"Vi konstruerede generne af E coli stamme sådan, at dens overlevelse afhang af at forstyrre interaktionen mellem det humane protein og et HIV-protein, " sagde Tavassoli. Hans team fandt tre potentielle terapeutiske midler. Yderligere test viste, at en af de tre fungerede bedst. I et reagensglas og i celler, forbindelsen bundet til det humane protein, forhindre HIV-proteinet i at interagere med det.
Dette lægemiddel vil sandsynligvis ikke blive brugt terapeutisk, imidlertid, da det kan have toksiske bivirkninger ved høje doser som følge af dets interaktion med det humane protein, sagde forskerne.
"Det virkelige fremskridt her er evnen til at generere biblioteker med millioner af potentielt terapeutiske midler, " sagde Tavassoli. "Disse kunne screenes for at identificere inhibitorer af andre sygdomsrelaterede processer, det er der, dets reelle potentiale ligger."
 Varme artikler
Varme artikler
-
 Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier,
Elektrokemi skyller antibiotikaresistente proteiner udKredit:EPFL Alain Herzog /Yingdi Zhu, Horst Pick EPFL-forskere, arbejder i samarbejde med Valais Hospital i Sion og Fudan University i Shanghai, har udviklet en metode til at analysere bakterier, -
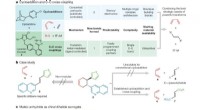 Det bedste fra begge verdener:Kombination af to skeletopbyggende kemiske reaktioneren, Sammenligning af cycloaddition og C-C krydskobling. Bu, butyl; R–X, elektrofil; R′–M, nukleofil. b, Casestudie:retrosyntetisk analyse af enantiopren byggesten 3. Denne byggesten kunne i teorien da
Det bedste fra begge verdener:Kombination af to skeletopbyggende kemiske reaktioneren, Sammenligning af cycloaddition og C-C krydskobling. Bu, butyl; R–X, elektrofil; R′–M, nukleofil. b, Casestudie:retrosyntetisk analyse af enantiopren byggesten 3. Denne byggesten kunne i teorien da -
 Ny klasse af materialer kunne bruges til at lave batterier, der oplades hurtigereKredit:CC0 Public Domain Forskere har identificeret en gruppe materialer, der kunne bruges til at lave batterier med endnu højere effekt. Forskerne, fra University of Cambridge, brugte materialer
Ny klasse af materialer kunne bruges til at lave batterier, der oplades hurtigereKredit:CC0 Public Domain Forskere har identificeret en gruppe materialer, der kunne bruges til at lave batterier med endnu højere effekt. Forskerne, fra University of Cambridge, brugte materialer -
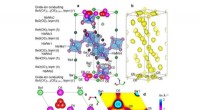 Nye materialer med høj ilt-ion-ledningsevne åbner en bæredygtig fremtidEksperimentelt bevis for den interstitielle oxygen O5 og O1-O5 oxid-ion-interstitialitet diffusion af Ba7Nb3.9Mo1.1O20.05 ved en høj temperatur på 800 oC. Kredit:Tokyo Institute of Technology Fors
Nye materialer med høj ilt-ion-ledningsevne åbner en bæredygtig fremtidEksperimentelt bevis for den interstitielle oxygen O5 og O1-O5 oxid-ion-interstitialitet diffusion af Ba7Nb3.9Mo1.1O20.05 ved en høj temperatur på 800 oC. Kredit:Tokyo Institute of Technology Fors
- Europæiske bilproducenter læder anvender brændstof til skovrydning:NGO
- Forskere øger mikrobølgesignalets stabilitet hundrede gange
- Indfødte grupper advarer Paris -aftalen, der er truet af skovrydning
- En ny miljøvenlig og bæredygtig algebaseret måde at bekæmpe vandforurening på
- Spider dragline silke som torsionsaktuator drevet af fugt til applikationer som kunstig muskel
- Låsning af grafeners superledende kræfter med et twist og et klem


