Vrikkende og jiggling:Undersøgelse forklarer, hvordan organismer udvikler sig til at leve ved forskellige temperaturer

Et enzyms dans under den biologiske reaktion, det fremmer, afgør, ved hvilken temperatur enzymet fungerer bedst. Kredit:Dr. Marc van der Kamp og Michael Connolly
Den geniale fysiker Richard Feynman sagde berømt, at i princippet, biologi kan forklares ved at forstå atomernes slingre og svingninger. For første gang, ny forskning fra University of Bristol, Storbritannien og University of Waikoto, New Zealand forklarer, hvordan denne 'vrikke og jiggling' af atomerne i enzymer - de proteiner, der får biologiske reaktioner til at ske - er 'koreograferet' for at få dem til at arbejde ved en bestemt temperatur. Enzymkatalyse er afgørende for livet, og denne forskning kaster lys over, hvordan enzymer har udviklet sig og tilpasset sig, gør det muligt for organismer at udvikle sig til at leve ved forskellige temperaturer.
Dette er den første undersøgelse, der forbinder enzymets dans (i atomare detaljer) direkte til dets optimale temperatur. Disse resultater giver ny indsigt i, hvordan strukturen af enzymer er relateret til dens rolle som katalysator og vigtigst af alt, kunne give en vej til at designe bedre biokatalysatorer til brug i kemiske reaktioner i industrielle processer, såsom fremstilling af lægemidler. Det antyder også, hvorfor proteiner i sidste ende blev foretrukket af evolutionen frem for nukleinsyrer som katalysatorer i biologi:Proteiner giver meget større evne til at 'tune' deres 'jigling og vrikke' og deres reaktion på kemiske reaktioner.
Dr. Marc van der Kamp og professor Adrian Mulholland (Bristol) arbejdede sammen med professor Vic Arcus (Waikoto, NZ) og kolleger, for at finde ud af, hvordan 'vrikke og jikke', eller enzymernes dynamik 'tunes ned' under den reaktion, de katalyserer. Som resultat, enzymernes varmekapacitet ændres under reaktionen, og det er størrelsen af denne ændring, der er den kritiske faktor for at bestemme den temperatur, ved hvilken enzymet fungerer bedst.
Så hvad får et enzyms varmekapacitet til at ændre sig under reaktionen? Og hvordan er det anderledes i forskellige enzymer, så deres katalytiske aktiviteter er indstillet til at passe til organismen og temperaturen i det miljø, de lever i?
Dr. Van der Kamp sagde:"Vores computersimuleringer af 'vrikke og jiggling' af enzymer på forskellige stadier i reaktionen fortæller os, hvordan disse strukturelle udsving giver anledning til forskellen i varmekapacitet, og derved kan forudsige den optimale temperatur for et enzym. Vores arbejde viste, at vi kan gøre dette præcist for to helt forskellige enzymer, ved at sammenligne med eksperimentelle data.
"Det, der er fascinerende at se, er, at hele enzymstrukturen er vigtig:'dansen' ændrer sig ikke kun tæt på, hvor den kemiske reaktion finder sted, men også i dele meget længere væk. Dette har konsekvenser for evolutionen:Kombinationen af enzymstrukturen og den reaktion, enzymet katalyserer, vil definere dets optimale arbejdstemperatur. En subtil ændring i strukturen kan ændre 'dansen'."
Værket hjælper med at forklare, hvordan organismer kan udvikle sig til at leve ved forskellige temperaturer, og antydninger til, hvorfor proteiner i sidste ende blev foretrukket af evolutionen frem for nukleinsyrer som katalysatorer i biologien:Proteiner tilbyder meget større evne til at 'tune' deres 'jigling and wiggling' og deres respons på kemiske reaktioner.
Enzymer har en optimal temperatur, ved hvilken de er mest katalytisk aktive. over den temperatur, de bliver mindre aktive. Lærebogens forklaring er, at enzymer udfolder sig (mister deres funktionelle form), men dette er ikke korrekt. I stedet, en grundlæggende fysisk egenskab - varmekapaciteten - forklarer og forudsiger enzymers temperaturafhængighed. Varmekapaciteten ændres under reaktionen og 'tunes' til at give den optimale temperatur.
Sidste artikelMat lokkemad, kroger og ødelægger forurenende stoffer i vand
Næste artikelDet perfekte shot af espresso hver gang med kemi
 Varme artikler
Varme artikler
-
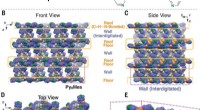 Materiale fremstillet af enkeltmolekyle selvdanner sig til et gitter, der kan helbrede sig selv, lag…Tilstande af C – H ··· N -bindinger i Py åben EMeCN og krystal-pakningsdiagrammer over Pyopen⊃MeCN. (A) Tegninger, der repræsenterer tilstande for C – H ··· N -bindinger i Py åben ⊃MeCN. (B til E)
Materiale fremstillet af enkeltmolekyle selvdanner sig til et gitter, der kan helbrede sig selv, lag…Tilstande af C – H ··· N -bindinger i Py åben EMeCN og krystal-pakningsdiagrammer over Pyopen⊃MeCN. (A) Tegninger, der repræsenterer tilstande for C – H ··· N -bindinger i Py åben ⊃MeCN. (B til E) -
 Ny teknik kan registrere urenheder i hakket oksekød inden for få minutterYaxi Hu indlæser et spektrometer med en prøve af hakket oksekød i fødevareforskningslaboratoriet på UBC. Kredit:Paul Joseph/UBC Forskere ved University of British Columbia har fundet en bedre måde
Ny teknik kan registrere urenheder i hakket oksekød inden for få minutterYaxi Hu indlæser et spektrometer med en prøve af hakket oksekød i fødevareforskningslaboratoriet på UBC. Kredit:Paul Joseph/UBC Forskere ved University of British Columbia har fundet en bedre måde -
 Hvad er et atom?Vidste du, at alt i universet er lavet af stof, og alle atomer er stykker af stof? Så alt, hvad du kan røre ved, er lavet af atomer, også din krop. Du kan lære alt om atomer i kemi. Hvad er et ato
Hvad er et atom?Vidste du, at alt i universet er lavet af stof, og alle atomer er stykker af stof? Så alt, hvad du kan røre ved, er lavet af atomer, også din krop. Du kan lære alt om atomer i kemi. Hvad er et ato -
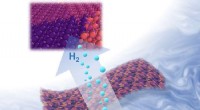 Forskere bruger jiggly Jell-O til at lave kraftfuld ny brintbrændstofkatalysatorTo-dimensionelle metalcarbider udløser en reaktion, der deler vand i ilt og værdifuld hydrogengas. Berkeley-forskere har opdaget en let ny opskrift på tilberedning af disse nanometer-tynde plader, der
Forskere bruger jiggly Jell-O til at lave kraftfuld ny brintbrændstofkatalysatorTo-dimensionelle metalcarbider udløser en reaktion, der deler vand i ilt og værdifuld hydrogengas. Berkeley-forskere har opdaget en let ny opskrift på tilberedning af disse nanometer-tynde plader, der
- Fra drivhusgas til 3D-overflademikroporøs grafen
- Hvad er de sidste faser i en stjerners liv i størrelse med solen?
- Atlatl-artefakter i lille skala tyder på, at børn blev undervist i at bruge dem
- Sådan beregnes ydelseskoefficienten
- Levende sensorer undersøger tarmens mysterier
- Hvordan appellerer lyse farver til børn?


