Skyerne af spaghetti, der holder DNA-data sikre

Forskere ved Rockefeller University og Albert Einstein College of Medicine har identificeret en finurlig biofysisk mekanisme, der hjælper celler med at undgå databrud. Kredit:Michael Cowburn og David Rout
Celler kan undgå "databrud", når de lader signalproteiner komme ind i deres kerner takket være en finurlig biofysisk mekanisme, der involverer en sløring af spaghetti-lignende proteiner, forskere fra Rockefeller University og Albert Einstein College of Medicine har vist. Deres undersøgelse vises i 23. marts-udgaven af Journal of Biological Chemistry .
I enhver menneskelig celle, alle kroppens tegninger og instruktioner er gemt i form af DNA inde i kernen. Molekyler, der skal rejse ind og ud af kernen - for at tænde eller slukke for gener eller hente information - gør det gennem passager kaldet nukleare porekomplekser (NPC'er). Trafik gennem disse NPC'er skal være stramt kontrolleret for at forhindre DNA-kapring af vira eller fejlfunktion som i cancer.
For at rejse gennem NPC'er, mange molekyler skal være knyttet til proteiner kaldet transportfaktorer (TF'er), som fungerer som shuttles, som NPC genkender. Men NPC står over for en udfordring:Det skal nøjagtigt genkende og binde sig til TF'er for at lade dem komme igennem uden at indrømme uønsket trafik, men den skal slippe dem igennem hurtigt – i løbet af få millisekunder – for at cellen kan udføre sine pligter. Proteiner, der vides at binde nøjagtigt til specifikke molekyler, som antistoffer, holder sig normalt til deres mål i perioder på op til måneder.
"Hvordan i alverden har du den slags specificitet, som vi ser i protein-protein-interaktioner som antistoffer, og alligevel have den slags hastighed, som vi ser med vand fra en teflonpande?" spurgte Michael Rout, professor ved Rockefeller University, som var en af medforfatterne til værket.
For at undersøge dette paradoks, Routs team – i samarbejde med et team ledet af David Cowburn ved Albert Einstein College of Medicine – så på materialet inde i den nukleare pore. Åbningen er foret med en type proteiner kendt som iboende uordnede polypeptider - stræk af aminosyrer uden en synlig, defineret form.
"De ting, der fylder NPC er... ligesom spaghetti, meget lange tråde lavet af slags vrikkende ting, " sagde Ryo Hayama, postdoc-stipendiaten, der var en af studiets medførsteforfattere.
De iboende forstyrrede polypeptider i NPC kaldes phenylalanin-glycin nukleoporiner, eller FG Nups. Interaktionerne mellem FG Nups og TF'er er nøglen til den nukleare pores gatekeeping-funktion. Men hvordan denne interaktion fungerer, enten i raske eller syge celler, er ikke godt forstået, hovedsageligt på grund af udfordringerne ved at studere proteiner med iboende lidelse.
"Konventionelle metoder som elektronmikroskopi eller krystallografi kan kun give et meget bogstaveligt sløret billede, fordi proteinerne i sig selv er slørede, " sagde Rout. "De er uordnede og bevæger sig rundt."
Hayama og co-first forfatter Samuel Sparks udførte termodynamiske eksperimenter, hvor de konstruerede FG Nups med forskellige antal FG-gentagelser og målte, hvor meget varme de afgav, når de blev blandet med transportfaktorproteiner. Disse data kunne bruges til at beregne, hvordan antallet af kontaktpunkter mellem transportfaktoren og NPC påvirkede, hvor stærkt og hurtigt de bandt til hinanden.
De fandt ud af, at nøglen til denne interaktion var så specifik, dog flygtig, var i mange hurtige, forbigående kontakter mellem transportfaktorer og FG Nups. På samme måde som trådene og krogene til velcro, hvert aminosyrepar i FG Nup-regionen er kun knyttet meget svagt til transportfaktoren, med et samlet resultat af affinitet mellem de to partnere; men i modsætning til velcro, partnerne sad ikke sammen længere end nødvendigt for at transportfaktoren kunne rejse gennem atomporen.
"Jeg kan ikke komme i tanke om nogen analogi i det normale liv, der gør, hvad dette gør, " sagde Rout. "Du har denne sløring af (aminosyrer), der kommer til og fra (transportfaktoren) med ekstraordinær hastighed."
Denne "fuzzy" interaktion er usædvanlig, og muligvis et ekstremt tilfælde blandt protein-protein-interaktioner i celler, sagde Cowburn. Men at forstå det er vigtigt for at kontrollere adgangen til kernen, en nøglesårbarhed i cellefunktion." I kræftformer, der kan være mutationer i det nukleare porekompleks og i celletransportfaktorer, " sagde Cowburn. "Og, ligeledes, adskillige vira er kendt for bevidst at målrette det nukleare porekompleks og transportfaktorer og ændre dem for at tilrane sig (cellen) til deres egne formål. Præcis hvad de laver og hvordan de gør det vides stadig ikke, fordi vi stadig forsøger at adskille den normale mekanisme."
 Varme artikler
Varme artikler
-
 Bro over tumorvoldgrave med potente lægemiddelleveringspartiklerKredit:American Chemical Society På trods af store anstrengelser, kræft er fortsat en formidabel sygdom, med hver malign subtype, der reagerer forskelligt på terapeutika. En forhindring, der er sp
Bro over tumorvoldgrave med potente lægemiddelleveringspartiklerKredit:American Chemical Society På trods af store anstrengelser, kræft er fortsat en formidabel sygdom, med hver malign subtype, der reagerer forskelligt på terapeutika. En forhindring, der er sp -
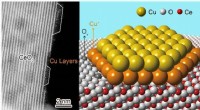 Forskere identificerer atomstruktur af katalytisk aktiv kobber-ceria-grænsefladeAtomstruktur af kobber-ceria-grænsefladen Kredit:DICP For nylig, Dr. Zhou Yan og prof. Shen Wenjie ved Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi og deres sama
Forskere identificerer atomstruktur af katalytisk aktiv kobber-ceria-grænsefladeAtomstruktur af kobber-ceria-grænsefladen Kredit:DICP For nylig, Dr. Zhou Yan og prof. Shen Wenjie ved Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi og deres sama -
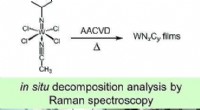 Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa
Simuleret kemisk dampaflejring fra en wolframcarbonitridforløberKredit: European Journal of Inorganic Chemistry Tynde film spiller en central rolle i produktionen af elektronik. De kan dyrkes direkte på en substratoverflade gennem processen med kemisk dampa -
 Sådan beregnes ændringen i temperaturTermodynamik er det fysiske felt, der beskæftiger sig med temperatur, varme og i sidste ende energioverførsler. Selvom lovene om termodynamik kan være lidt vanskelige at følge, er den første lov om te
Sådan beregnes ændringen i temperaturTermodynamik er det fysiske felt, der beskæftiger sig med temperatur, varme og i sidste ende energioverførsler. Selvom lovene om termodynamik kan være lidt vanskelige at følge, er den første lov om te
- Fordele og ulemper ved Bacillus Expressions System
- Forskere giver et indblik i dinosaurernes økosystemer
- Statistik plotter forurening for at informere politik
- Hvor meget kulstof kan jorden optage med mere kuldioxid i atmosfæren?
- Triple Star System kunne være en fantastisk cocktail -shaker for livet
- Beskyttelse af tempereret gammel regnskov er nøglen til en bæredygtig fremtid


