Konstruktion af et plast-spisende enzym
Kredit:University of Portsmouth
Forskere har udviklet et enzym, der kan fordøje nogle af vores mest forurenende plastmaterialer, at levere en potentiel løsning på et af verdens største miljøproblemer.
Opdagelsen kan resultere i en genbrugsløsning for millioner af tons plastflasker, lavet af polyethylenterephthalat, eller PET, som i øjeblikket vedvarer i hundredvis af år i miljøet.
Forskningen blev ledet af teams ved University of Portsmouth og US Department of Energy's National Renewable Energy Laboratory (NREL) og er offentliggjort i Procedurer fra National Academy of Sciences ( PNAS ).
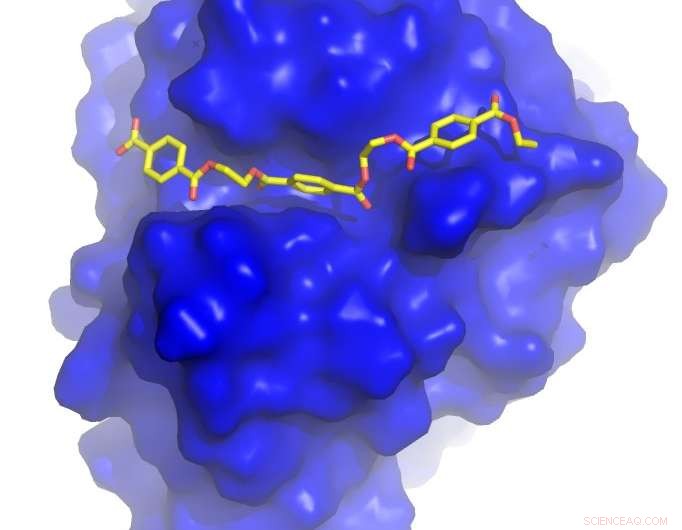
Professor John McGeehan ved University of Portsmouth og Dr. Gregg Beckham ved NREL løste krystalstrukturen i PETase - et nyligt opdaget enzym, der fordøjer PET - og brugte disse 3D -oplysninger til at forstå, hvordan det fungerer. Under denne undersøgelse, de uforvarende konstruerede et enzym, der er endnu bedre til at nedbryde plastikken end det, der udviklede sig i naturen.
Forskerne arbejder nu på at forbedre enzymet yderligere, så det kan bruges industrielt til at nedbryde plast på en brøkdel af tiden.
Professor McGeehan, Direktør for Institute of Biological and Biomedical Sciences på School of Biological Sciences i Portsmouth, sagde:"De færreste kunne have forudsagt, at siden plast blev populært i 1960'erne, ville der findes store plastaffaldspletter flydende i oceaner, eller skyllet op på engang uberørte strande over hele verden.
"Vi kan alle spille en væsentlig rolle i håndteringen af plastproblemet, men det videnskabelige samfund, der i sidste ende skabte disse 'undermaterialer', skal nu bruge al den teknologi, de råder over, til at udvikle reelle løsninger. "
Forskerne fik gennembruddet, da de undersøgte strukturen af et naturligt enzym, som menes at have udviklet sig i et affaldsgenvindingscenter i Japan, tillader en bakterie at nedbryde plast som fødekilde.
KÆLEDYR, patenteret som en plastik i 1940'erne, ikke har eksisteret i naturen meget længe, så teamet satte sig for at bestemme, hvordan enzymet udviklede sig, og om det kunne være muligt at forbedre det.
Målet var at bestemme dets struktur, men de endte med at gå et skridt videre og konstruerede ved et uheld et enzym, som var endnu bedre til at nedbryde PET -plast.
"Serendipitet spiller ofte en væsentlig rolle i grundlæggende videnskabelig forskning, og vores opdagelse her er ingen undtagelse, "Sagde professor McGeehan.
"Selvom forbedringen er beskeden, denne uventede opdagelse tyder på, at der er plads til yderligere at forbedre disse enzymer, flytte os tættere på en genbrugsløsning til det stadigt voksende bjerg af kasseret plast. "
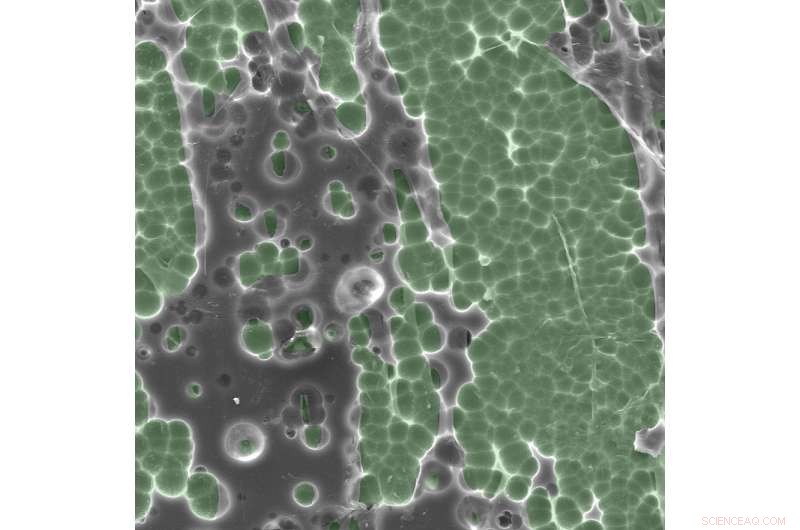
Elektronmikroskopfotos af enzym/substratinteraktioner. Kredit:Dennis Schroeder / NREL
Forskerteamet kan nu anvende værktøjerne inden for proteinteknik og evolution for fortsat at forbedre det.
University of Portsmouth og NREL samarbejdede med forskere ved Diamond Light Source i Storbritannien, en synkrotron, der bruger intense røntgenstråler 10 milliarder gange lysere end solen til at fungere som et mikroskop, der er stærkt nok til at se individuelle atomer.
Ved hjælp af deres nyeste laboratorium, beamline I23, en ultrahøj opløsning 3D-model af PETase-enzymet blev genereret i udsøgte detaljer.
Professor McGeehan sagde:"Diamantlyskilden skabte for nylig en af de mest avancerede røntgenstråler i verden, og adgang til denne facilitet gav os mulighed for at se 3D-atomstrukturen i PETase i utrolige detaljer. At kunne se de indre funktioner af denne biologiske katalysator gav os tegningerne til at konstruere et hurtigere og mere effektivt enzym. "
Administrerende direktør for Diamond Light Source, Professor Andrew Harrison, sagde:"Med input fra fem institutioner i tre forskellige lande, denne forskning er et fint eksempel på, hvordan internationalt samarbejde kan være med til at skabe betydelige videnskabelige gennembrud.
"Den detalje, som teamet var i stand til at trække ud af de resultater, der blev opnået på I23-strålelinjen ved Diamond, vil være uvurderlig i forhold til at skræddersy enzymet til brug i store industrielle genbrugsprocesser. Virkningen af en sådan innovativ løsning på plastaffald ville være globalt. Det er fantastisk, at britiske forskere og faciliteter hjælper med at gå forrest. "
Med hjælp fra beregningsmodelleringsforskerne ved University of South Florida og University of Campinas i Brasilien, teamet opdagede, at PETase ligner meget en cutinase, men det har nogle usædvanlige funktioner, herunder et mere åbent aktivt websted, i stand til at rumme menneskeskabte snarere end naturlige polymerer. Disse forskelle indikerede, at PETase kan have udviklet sig i et PET-holdigt miljø for at gøre enzymet i stand til at nedbryde PET. For at teste denne hypotese, forskerne muterede PETase aktive sted for at gøre det mere som en cutinase.
Og det var, da det uventede skete - forskerne fandt ud af, at PETase -mutanten var bedre end den naturlige PETase til at nedbryde PET.
Væsentligt, enzymet kan også nedbryde polyethylenfurandicarboxylat, eller PEF, en biobaseret erstatning for PET-plast, der hyldes som en erstatning for glasølflasker.
Professor McGeehan sagde:"Ingeniørprocessen er meget den samme som for enzymer, der i øjeblikket bruges i biovaskemidler og til fremstilling af biobrændstoffer - teknologien findes, og det er godt inden for muligheden for, at vi i de kommende år vil se en industrielt levedygtig proces til at vende PET og potentielt andre substrater som PEF, PLA, og PBS, tilbage i deres originale byggesten, så de kan genbruges bæredygtigt. "
Papirets hovedforfatter er kandidatstuderende i fællesskab finansieret af University of Portsmouth og NREL, Harry Austin.
Han sagde:"Denne forskning er kun begyndelsen, og der er meget mere at gøre på dette område. Jeg er glad for at være en del af et internationalt team, der tackler et af de største problemer, vores planet står over for."
Sidste artikelBrint som pedalhjælp
Næste artikelVideo:Hvad er flammejetting?
 Varme artikler
Varme artikler
-
 Antistofbiosensor tilbyder ubegrænset lægemiddelovervågning på stedetGrafisk oversigt over videnskaben bag antistofbiosensor. Kredit:Ecole Polytechnique Federale de Lausanne At kunne overvåge lægemiddelkoncentrationen i en patients blod er et vigtigt aspekt af enhv
Antistofbiosensor tilbyder ubegrænset lægemiddelovervågning på stedetGrafisk oversigt over videnskaben bag antistofbiosensor. Kredit:Ecole Polytechnique Federale de Lausanne At kunne overvåge lægemiddelkoncentrationen i en patients blod er et vigtigt aspekt af enhv -
 Bananplanteekstrakt kan være nøglen til mere cremet, længerevarende isSmå fibre ekstraheret fra bananplante rachis (cirklet) kunne hjælpe med at bremse issmeltningen. Kredit:Robin Zuluaga Gallego Ingen tvivl om det, is er en god fornøjelse på en varm dag. Det er, in
Bananplanteekstrakt kan være nøglen til mere cremet, længerevarende isSmå fibre ekstraheret fra bananplante rachis (cirklet) kunne hjælpe med at bremse issmeltningen. Kredit:Robin Zuluaga Gallego Ingen tvivl om det, is er en god fornøjelse på en varm dag. Det er, in -
 Elektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentialeElektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentiale. Indsat viser den cryo-EM-afledte struktur af en AAV2. Det fulde billede viser den eksperimentelt bestemte tæthed (grå) og
Elektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentialeElektronmikroskopi giver et nyt syn på lille virus med terapeutisk potentiale. Indsat viser den cryo-EM-afledte struktur af en AAV2. Det fulde billede viser den eksperimentelt bestemte tæthed (grå) og -
 Sådan finder du koncentrationen, når du får pHpH-værdien i en opløsning er lig med base 10-logaritmen i H + -koncentrationen ganget med -1. Hvis du kender pH-værdien i en vandopløsning, kan du bruge denne formel i omvendt rækkefølge til at finde
Sådan finder du koncentrationen, når du får pHpH-værdien i en opløsning er lig med base 10-logaritmen i H + -koncentrationen ganget med -1. Hvis du kender pH-værdien i en vandopløsning, kan du bruge denne formel i omvendt rækkefølge til at finde
- Tre dværg sfæroidale galakser fundet at rotere
- Sådan beregnes graden ud af 33 spørgsmål
- Fremme humanitær indsats i en digital verden
- Forskere arbejder på at skabe en køreplan for kvantematerialer
- Sådan beregnes total faldafstand for faldbeskyttelse
- På Madagaskar, fiskere planter mangrover for fremtiden


