Simulering af AsqJ-enzymet åbner op for nye muligheder for farmaceutisk kemi
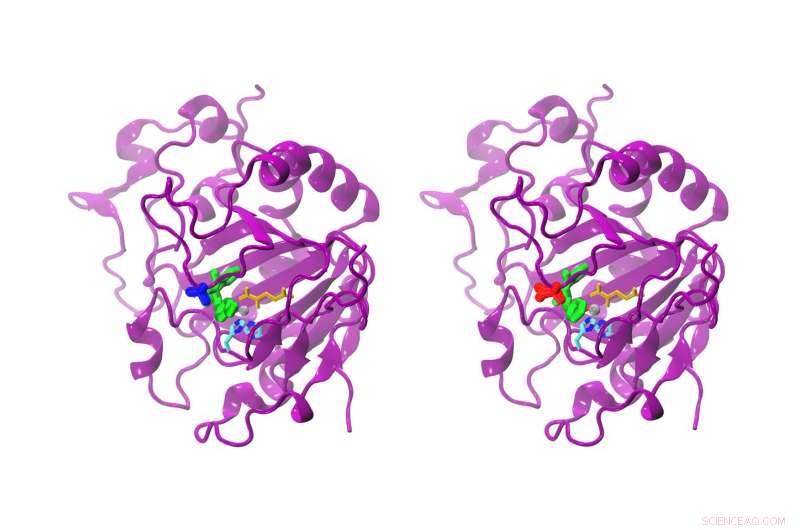
Mens forskellen mellem den naturlige og den modificerede AsqJ kun er én aminosyre, reaktiviteten er klart anderledes. Den naturlige AsqJ (venstre) har en valin i position 72 (blå). Den modificerede form har en isoleucin (rød) i position 72. Substratet i det aktive sted er grønfarvet, alfa-ketoglutarat gul, det grå jernatom, og to histidinkæder cyan og blå. Kredit:Sophie Mader/TUM
Praktisk talt alle biokemiske processer involverer enzymer, der fremskynder kemiske reaktioner. Et forskerhold fra det tekniske universitet i München (TUM) har nu for første gang dechifreret den molekylære mekanisme af enzymet AsqJ. Deres resultater kan åbne op for nye muligheder i produktionen af farmaceutisk aktive molekyler.
Uden enzymer, naturen ville gå i stå. Disse små molekyler fremskynder biokemiske reaktioner eller gør dem mulige i første omgang. Men hvordan sker det på et molekylært niveau? "At forstå den nøjagtige funktion af enzymer er en af de største udfordringer i moderne biokemi, " siger Ville Kaila, Professor i beregningsmæssig biokatalyse ved det tekniske universitet i München.
Forskerholdet ledet af Ville Kaila og Michael Groll, Professor i biokemi ved det tekniske universitet i München, har, for første gang, dechiffrerede mekanismen for enzymet aspoquinolon J (AsqJ), en dioxygenase, der aktiverer kulstofbindinger med oxygen.
Enzymet AsqJ er særligt spændende, da det katalyserer en kaskade af kemiske reaktioner, der i sidste ende fører til dannelsen af antibakterielle forbindelser. Det blev opdaget for kun få år siden i Aspergillus nidulans svamp. Forskerne kombinerede forskellige metoder til at afsløre hemmelighederne i enzymet:For det første, Alois Bräuer og prof. Michael Groll brugte røntgenkrystallografi til at bestemme molekylets tredimensionelle atomstruktur. Sophie Mader og Ville Kaila brugte derefter denne information til at udføre kvantemekaniske simuleringer på dets biokemiske processer.
"Vores beregninger illustrerer, hvordan enzymet katalyserer dannelsen af quinolonalkaloid, " rapporterer Kaila. "Små detaljer har fantastiske effekter:En lille ændring i underlaget, som fjernelse af en lille kemisk gruppe, er tilstrækkeligt til praktisk talt at stoppe reaktionen."
Næste, holdet designede beregningsmæssigt en ny variant af enzymet, der katalyserer dannelsen af quinolonalkaloider med det modificerede substrat. Dette nye enzym blev eksperimentelt produceret i bakterier og testet for dets funktionalitet. "Resultaterne var imponerende:den forventede reaktion fandt sted efter kun et par sekunder, " husker Bräuer.
"Dette eksperiment viser, at vores metode virker og også er egnet til at repræsentere funktionaliteten af andre enzymer på molekylært niveau, " siger Ville Kaila. Enzymdesign er stadig på et grundlæggende niveau, men det har et enormt potentiale. I fremtiden, vi kunne sigte mod beregningsmæssigt at designe medicinske lægemidler, for eksempel.
"Arbejdet viser, at vores metode er nøjagtig og også velegnet til at studere funktionaliteten af andre enzymer på molekylært niveau, " siger Ville Kaila. Enzymdesign er stadig grundforskning - men det har et enormt potentiale. Et mål med fremtidig forskning vil være at designe enzymer i en computer til, for eksempel, producere nye lægemidler.
Sidste artikelKuldioxid som råstof
Næste artikelMolekylært stillads hjælper konstruktion på nanoskala
 Varme artikler
Varme artikler
-
 Stabilisering af 2-D lagdelte perovskiter til fotovoltaik:Opsætning af en forsvarsmurSammenligning af RP og DJ fase 2D lagdelte perovskit strukturer. Kredit:DICP At opsætte en forsvarsmur i en fodboldkamp er en primær sportsudfordring. Ingen træner kan lide et hul mellem defensive
Stabilisering af 2-D lagdelte perovskiter til fotovoltaik:Opsætning af en forsvarsmurSammenligning af RP og DJ fase 2D lagdelte perovskit strukturer. Kredit:DICP At opsætte en forsvarsmur i en fodboldkamp er en primær sportsudfordring. Ingen træner kan lide et hul mellem defensive -
 Mærkning af brystimplantater med tomat -DNA for at forhindre forfalskningDr. Storsberg, videnskabsmand ved Fraunhofer IAP og et ekspertvidne i retssager centreret om brystimplantater, undersøger et brystimplantat med en utæt gelfyldning. Kredit:Fraunhofer IAP Årevis, e
Mærkning af brystimplantater med tomat -DNA for at forhindre forfalskningDr. Storsberg, videnskabsmand ved Fraunhofer IAP og et ekspertvidne i retssager centreret om brystimplantater, undersøger et brystimplantat med en utæt gelfyldning. Kredit:Fraunhofer IAP Årevis, e -
 Ny analyse finder en ny mekanisme bag ældning af røde blodlegemerKredit:CC0 Public Domain Røde blodlegemer er den hyppigst forekommende celletype i blodet, transporterer ilt gennem hele menneskekroppen. I blodcirkulationen, de støder gentagne gange på forskelli
Ny analyse finder en ny mekanisme bag ældning af røde blodlegemerKredit:CC0 Public Domain Røde blodlegemer er den hyppigst forekommende celletype i blodet, transporterer ilt gennem hele menneskekroppen. I blodcirkulationen, de støder gentagne gange på forskelli -
 LED'er lyser vejen til bedre lægemiddelterapierEn blå LED lyser på et hætteglas indeholdende tungt vand, en farmaceutisk forbindelse, og en lysaktiveret katalysator. Den nye fotokatalytiske tilgang fra Princetons David MacMillan forvandler en fler
LED'er lyser vejen til bedre lægemiddelterapierEn blå LED lyser på et hætteglas indeholdende tungt vand, en farmaceutisk forbindelse, og en lysaktiveret katalysator. Den nye fotokatalytiske tilgang fra Princetons David MacMillan forvandler en fler
- Sådan beregnes kPa
- Nanoskala øer prikker lysdrevet katalysator
- Kvanteberegning:Kolde chips kan styre qubits
- Astronauter på afbrudt Soyuz-opsendelse for at sprænge af sted igen til ISS
- Spin-oprydningsmetoden bringer praktiske kvantecomputere tættere på virkeligheden
- Kemiluminescensprober til hurtig og følsom påvisning af salmonella og listeria


