Forskere udvikler nyt kombinatorisk proteinbibliotek
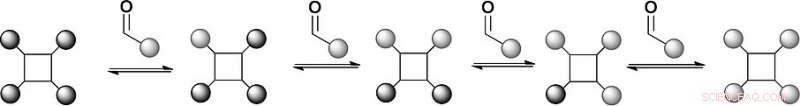
Kombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu, Britiske videnskabsmænd har udviklet et dynamisk kombinatorisk bibliotek til screening af supramolekylære ligandstrukturer, der genkender proteinoverflader og kan interferere med protein-protein-interaktion. Undersøgelsen er blevet offentliggjort i European Journal of Organic Chemistry .
Kombinatorisk kemi er blevet omfavnet af den farmaceutiske industri, fordi den giver kemikere mulighed for at skabe store mængder molekyler og teste dem for ønskede egenskaber, for eksempel, bindingsaffiniteter til et terapeutisk vigtigt mål. Syntese og screening er forbundet i dynamisk kombinatorisk kemi, da de dynamiske kombinatoriske biblioteker kan ændre deres produktdistribution som svar på målbinding. Denne produkt-amplifikationsproces genererer supramolekylære strukturer, som ellers er svære at få adgang til, og tillader hurtig identifikation af bindingsarkitekturer, for eksempel, inhibitorer, der binder til det aktive sted af et enzym.
Imidlertid, proteinoverflader er store tredimensionelle strukturer med pletter af forskellig hydrofobicitet, surhedsgrad, og grundlæggende, findes i forskellige positioner på deres overflade. Derfor, screeningen af inhibitorer af protein-protein-interaktioner skal involvere mere komplekse ligander end dem, der er nødvendige for aktiv site-genkendelse "Vi var nødt til at identificere reversibel kemi og analytisk metodologi, som ville være forenelig med ideen om at lave dynamisk kombinatorisk kemi til proteinoverfladegenkendelse, " siger Andrew J. Wilson, den tilsvarende forfatter til undersøgelsen, der blev udført ved University of Leeds.
Forskerne valgte et tetraphenylporphyrin stillads med fire hydrazider og substituerede benzaldehyder som genkendelsesarme, der reversibelt ville forbindes med hydraziderne for at danne hydrazoner. Porphyrinerne er etablerede stilladser til proteinoverfladegenkendelse, men hydrazon-kemien er syntetisk udfordrende. "Vi har et stillads med fire hydrazoner, så vi kan udveksle kemi på fire forskellige positioner, " siger Wilson. Derudover reversibel hydrazondannende kemi finder normalt sted ved en sur pH, men proteiner foretrækker en neutral pH. Forskerne adresserede dette problem ved at tilføje en anilinbaseret katalysator, hvilket skubbede hydrazonudvekslingsreaktionen mod termodynamisk ligevægt ved tæt på neutral pH.
I den første opsætning af dette modelbibliotek, forskerne prøvede to substituerede aldehydligander, som dannede en ligevægt med den benzaldehyd-afledte hydrazon. Massespektrometrianalyse viste, at produktfordelingen var i termodynamisk ligevægt, og liganderne udveksles faktisk ved reversibel reaktion. Dette betyder, at betingelserne for et dynamisk kombinatorisk bibliotek til proteinoverfladegenkendelse blev fastsat. Næste, forskerne planlægger at uddybe denne tilgang til at studere det protein-rettede udvalg af proteinoverflademimetika.
 Varme artikler
Varme artikler
-
 Lysstyret reversibel aggregering af mikrotubuli medieret af paclitaxel-modificeret cyclodextrinKredit:Wiley En kombination af naturlige mikrotubuli og syntetiske makrocykliske receptorer giver mulighed for lyskontrollerede, reversibel aggregering af mikrotubulierne til større nanostrukturer
Lysstyret reversibel aggregering af mikrotubuli medieret af paclitaxel-modificeret cyclodextrinKredit:Wiley En kombination af naturlige mikrotubuli og syntetiske makrocykliske receptorer giver mulighed for lyskontrollerede, reversibel aggregering af mikrotubulierne til større nanostrukturer -
 Sådan konverteres atomer til gramKonvertering af atomer til gram er en vigtig proces i grundlæggende kemi og danner grundlaget for de vanskeligere beregninger, der anvendes i mere avanceret kemi. Konverteringen kræver en grundlægg
Sådan konverteres atomer til gramKonvertering af atomer til gram er en vigtig proces i grundlæggende kemi og danner grundlaget for de vanskeligere beregninger, der anvendes i mere avanceret kemi. Konverteringen kræver en grundlægg -
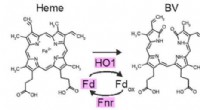 Effektiv syntese af et fotosyntetisk pigment i pattedyrceller til optogenetikFire enzymer, der kræves til PCB-syntese fra hæm (HO1, PCyA, Fd, Fnr). Forskergruppen lykkedes med at syntetisere PCB i dyreceller ved at introducere disse fire enzymgener. Kredit:NIBB Den optogen
Effektiv syntese af et fotosyntetisk pigment i pattedyrceller til optogenetikFire enzymer, der kræves til PCB-syntese fra hæm (HO1, PCyA, Fd, Fnr). Forskergruppen lykkedes med at syntetisere PCB i dyreceller ved at introducere disse fire enzymgener. Kredit:NIBB Den optogen -
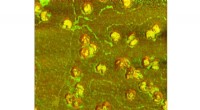 Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr
Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr
- Den skarpeste laser i verden:Fysikere udvikler en laser med en linjebredde på kun 10 mHz
- Fossiliseret slim af 100 millioner år gammel hagfish ryster op i hvirveldyrs stamtræ
- Trods klar himmel under pandemien, drivhusgasemissionerne stiger stadig
- Venlige bakterier i centrum:Behandling af spildevand med mindre energi og lavere emissioner
- Marine hvirvelløse dyr har støjende menneskelige naboer
- EU -parlamentet godkender forbud mod engangsplast


