Nyt RNA-modificerende værktøj korrigerer genetiske sygdomme, herunder driver af triple-negativ brystkræft

Professor Matthew Disney fra The Scripps Research Institute ledede den nye undersøgelse. Kredit:Scripps Research Institute
Efterhånden som forskere får indsigt i, hvilke gener der driver sygdomme, de forfølger det næste logiske spørgsmål:Kan genredigeringsteknologier udvikles til at behandle eller endda helbrede disse sygdomme? Meget af denne indsats har fokuseret på at udvikle teknologier som CRISPR-Cas9, et proteinbaseret system.
På Scripps Research Institute campus i Florida, kemiker Matthew D. Disney, Ph.D., har taget en anden tilgang, udvikle et lille molekyle-baseret værktøj, der virker på RNA for selektivt at slette visse genprodukter.
Disneys sletteværktøj åbner muligheden for at skabe lægemidler, der bekvemt kan tages som piller for at rette genetiske sygdomme – ved at ødelægge giftige genprodukter, og ved kemisk at kontrollere kroppens forsvarsmekanismer. Papiret, "Lille molekyle målrettet rekruttering af en nuklease til RNA, " blev udgivet online af Journal of the American Chemical Society .
"Disse undersøgelser, ligesom meget videnskab, var omkring et årti undervejs. Vi er meget spændte på at se, hvordan denne indledende applikation udvikler sig, "Disney siger. "Denne forskning viser yderligere, at RNA faktisk er et levedygtigt mål til fremstilling af medicin."
RNA'er repræsenterer en forskelligartet gruppe af molekyler i celler, der fungerer som cellernes arbejdere, læsning, regulere og udtrykke DNA's genetiske instruktioner. Inden i vores celler, RNA'er er konstant i bevægelse. De samler, de udfører deres pligter, og så bliver de brudt op til genbrug af RNA-nedbrydende enzymer, som er kemiske sakse, der skærer andre molekyler fra hinanden.
Mens omkring 2 procent af vores genom koder for proteiner, 70 til 80 procent af genomet transskriberes til RNA, potentielt tilbyde betydeligt flere lægelige mål, Disney siger. Indtil for nylig, imidlertid, de fleste forskere anså RNA'er for uhæmmende, på grund af deres lille størrelse og relative mangel på stabilitet.
Disneys innovation binder et lægemiddellignende molekyle – et manipuleret til at binde præcist og selektivt til et specifikt RNA – til et almindeligt RNA-nedbrydende enzym. Det lille molekyle/enzymkompleks er designet til at låse sig fast på det uønskede genprodukt og ødelægge det. Disney kaldte teknologien RIBOTAC, en forkortelse for "ribonuklease-målrettede kimærer".
For at teste RIBOTAC-teknologien, Disney valgte for sit RNA-nedbrydende enzym RNase L, som er en kritisk del af det humane antivirale immunrespons. Til stede i små mængder i hver celle, produktionen af RNase L stiger typisk ved viral infektion for at ødelægge det virale RNA og overvinde sygdommen.
For det andet stykke af RIBOTAC-komplekset, dets lægemiddellignende molekyle, Disney valgte Targaprimir-96, et molekyle udviklet af hans laboratorium i 2016 til at binde med et mikroRNA-onkogen, der er kendt for at øge kræftcelleproliferation, især ved svær at behandle triple-negativ brystkræft, miRNA-96.
Ødelæggelsen af onkogenet førte til en genopvågning af kræftcellens medfødte selvdestruktionsprogram, via en stigning i FOXO1-genet, som i sidste ende ansporede de ondartede cellers død, siger Matthew G. Costales, første forfatter af papiret og en kandidatstuderende i Disney-laboratoriet.
"Forankring af vores tidligere arbejde med Targaprimir-96 til den målrettede rekruttering af RNase L, vi var i stand til at programmere RIBOTACs tilgang til kun at nedbryde celler, der i høj grad udtrykker miRNA-96 onkogenet, således at FOXO1 kan signalere selektiv ødelæggelse af tredobbelt negative brystkræftceller, " siger Costales.
At vække kroppens evne til at dræbe sin egen kræft ved at udnytte cellernes RNA-nedbrydningssystem tilbyder en ny tilgang til at angribe kræft, Disney siger. RIBOTAC-teknologien har også potentielt brede anvendelser til cancer og andre gen-drevne sygdomme, han siger.
"Jeg tror, at dette kun er toppen af isbjerget af, hvordan denne tilgang i sidste ende vil blive anvendt, " siger Disney.
Disneys laboratorium har brugt mange år på at udvikle en beregningsmetode kaldet Inforna til at matche RNA'er med tilstrækkelig stabilitet og struktur til små, lægemiddellignende molekyler, der er i stand til at binde sig til dem. Hans teknik førte til udviklingen af Targaprimir-96 og flere andre sygdomsmodificerende forbindelser, hvoraf nogle nu bevæger sig mod klinisk udvikling.
"Da det nu er kendt, at RNA er en nøglefaktor i næsten enhver sygdom, optimering af denne tilgang, der vender en celles naturlige forsvar mod at ødelægge sygdomsfremkaldende RNA'er, er sandsynligvis bredt anvendelig. Vi vil være laser-fokuseret på sygdomme, som der ikke findes nogen kendt kur mod, og som har en dårlig prognose, såsom svære at behandle kræftformer og uhelbredelig genetisk sygdom hos mennesker, " siger Disney. "Jeg er spændt på at se, hvor vi og andre i sidste ende tager dette."
 Varme artikler
Varme artikler
-
 Kemikere rapporterer en detaljeret beskrivelse af azopyrazoloniske farvestofferRUDN-kemikere identificerede strukturen af azopyrazolonfarvestoffer. Kredit:Allen Dressen RUDN-kemikere har identificeret strukturen af azopyrazolonfarvestoffer. Den nye udvikling vil gøre der
Kemikere rapporterer en detaljeret beskrivelse af azopyrazoloniske farvestofferRUDN-kemikere identificerede strukturen af azopyrazolonfarvestoffer. Kredit:Allen Dressen RUDN-kemikere har identificeret strukturen af azopyrazolonfarvestoffer. Den nye udvikling vil gøre der -
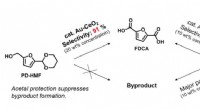 Ny metode muliggør storskalaproduktion af biobaserede plastikflaskerKonventionelle metoder producerer biprodukter, hvilket gør storstilet FDCA-produktion vanskelig, mens denne nye metode giver FDCA effektivt uden dannelse af biprodukter. Kredit:Kim M., et al., Angewan
Ny metode muliggør storskalaproduktion af biobaserede plastikflaskerKonventionelle metoder producerer biprodukter, hvilket gør storstilet FDCA-produktion vanskelig, mens denne nye metode giver FDCA effektivt uden dannelse af biprodukter. Kredit:Kim M., et al., Angewan -
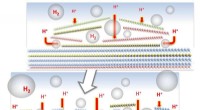 Bobler hjælper nye katalysatorer med at optimere sig selvEn elektrokatalysator skabt ved Rice University viste sig at være lige så effektiv som platin til produktion af brint. Processen skaber brintbobler mellem planer af det lagdelte materiale, som bryder
Bobler hjælper nye katalysatorer med at optimere sig selvEn elektrokatalysator skabt ved Rice University viste sig at være lige så effektiv som platin til produktion af brint. Processen skaber brintbobler mellem planer af det lagdelte materiale, som bryder -
 Smuk som en påfugl:Ædelstenen til næste generation af smarte sensorerKredit:CC0 Public Domain Forskere har hentet inspiration fra biomimik af sommerfuglevinger og påfuglefjer for at udvikle et innovativt opallignende materiale, der kunne være hjørnestenen i næste g
Smuk som en påfugl:Ædelstenen til næste generation af smarte sensorerKredit:CC0 Public Domain Forskere har hentet inspiration fra biomimik af sommerfuglevinger og påfuglefjer for at udvikle et innovativt opallignende materiale, der kunne være hjørnestenen i næste g
- Tesla banker $1, 100 rabat på Model 3
- Fire nyopdagede Mælkevejs-naboer
- Mørke himmel-forordninger for at dæmpe Pittsburghs lysforurening
- Orme eksploderer ud i rummet til muskeltabsmission
- Beskyttelse af Australiens Great Barrier Reef tager et kulturelt skift
- Virkningerne af jordforurening på planter og blomster


