Forskning forbedrer enzym, der nedbryder plastik
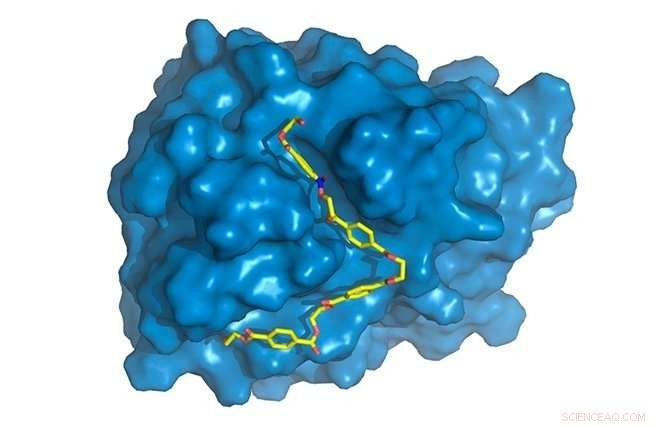
PETase er vist i blåt, med PET-kæde (gul) bundet til det aktive sted, hvor det vil blive forringet. Kredit:Rodrigo Leandro Silveira
Siden det blev opdaget, enzymet kendt som PETase har vakt stor videnskabelig interesse for dets evne til at fordøje PET (polyethylenterephthalat).
En polymer, der hovedsageligt anvendes til fremstilling af drikkeflasker (men også tøj, tæpper, og andre produkter), PET har den ulempe, at det er modstandsdygtigt over for nedbrydning. Flasker og andre genstande lavet af PET (polyethylenterephthalat) tager mindst 800 år om at nedbrydes biologisk på lossepladser eller i havet. Mellem 4,8 milliarder og 12,7 milliarder kilo plastik bliver hvert år dumpet i havene.
En undersøgelse med resultater offentliggjort for nylig i tidsskriftet Proceedings of the National Academy of Sciences ( PNAS ) viste, hvordan et internationalt team af samarbejdspartnere formåede at booste PETases kapacitet til at nedbryde plastik.
"I vores forskningsprojekt, vi karakteriserede den tredimensionelle struktur af enzymet, der kan fordøje denne plastik, konstrueret det til at øge dens nedbrydningskapacitet, og demonstreret, at det også virker på polyethylen-2, 5-furandicarboxylat (PEF), en PET-erstatning fremstillet af vedvarende råmaterialer, " sagde medforfatter Rodrigo Leandro Silveira, en postdoc ved University of Campinas's Chemistry Institute (IQ-UNICAMP).
En bakterie, der overlever at metabolisere PET
Interessen for PETase opstod i 2016, da en gruppe japanske forskere ledet af Shosuke Yoshida identificerede en ny bakterieart, Ideonella sakaiensis, der kan fodre på PET ved at bruge det som en kilde til kulstof og energi. Bakterien er fortsat den eneste kendte organisme med denne evne. Det vokser bogstaveligt talt på PET.
"Udover at identificere I. sakaiensis, de japanske videnskabsmænd opdagede, at det producerer to enzymer og udskiller dem i miljøet, " Silveira forklarede. "Et af de enzymer, der udskilles, er PETase. Fordi det har en vis grad af krystallinitet, PET er en polymer, der er meget svær at nedbryde. Men PETase angriber det og nedbryder det i små enheder af mono(2-hydroxyethyl)terephthalsyre, eller MHET. Enhederne af MHET omdannes derefter til terephthalsyre og absorberes og metaboliseres af bakterien."
I. Sakaiensis er den eneste levende organisme, der vides at bruge et syntetisk molekyle fremstillet af mennesker for at overleve. Det betyder, at bakterien er resultatet af en meget nylig evolutionær proces, der har udspillet sig i løbet af de sidste par årtier. Bakterien har tilpasset sig en polymer, der blev udviklet i begyndelsen af 1940'erne og først begyndte at blive brugt i industriel skala i 1970'erne. PETase er nøglen til at forstå hvordan.
"PETase gør den sværeste del, som nedbryder krystalstrukturen og depolymeriserer PET til MHET, " sagde den FAPESP-finansierede forsker. "Arbejdet udført af det andet enzym, som omdanner MHET til terephthalsyre, er meget enklere, fordi dets substrat består af monomerer, som enzymet nemt kan få adgang til, fordi de er spredt i reaktionsmediet. Af denne grund, forskning har fokuseret på PETase."
Modificeret enzym binder bedre til polymer
Det næste skridt var at studere PETase i detaljer, bidraget fra det nye forskningsprojekt. "Vi fokuserede på at finde ud af, hvad der giver PETase kapaciteten til at gøre noget, andre enzymer ikke kan gøre særlig effektivt. Vi startede med at karakterisere 3D-strukturen af dette protein, " forklarede Silveira.
"At opnå 3D-strukturen betyder at opdage x'et, y- og z-koordinater for hvert af de tusindvis af atomer, der udgør makromolekylet. Vores britiske kolleger gjorde dette ved at bruge en velkendt og meget brugt teknik kaldet røntgendiffraktion, der er tilgængelig på et laboratorium, der ligner Sirius, nu under opførelse i Campinas."
Når de havde opnået 3D-strukturen, forskerne begyndte at sammenligne PETase med relaterede proteiner. Den nærmeste slægtning er en cutinase af bakterien Thermobifida fusca, der nedbryder cutin, en slags naturlig fernis, der findes på planters blade. Visse patogene mikroorganismer bruger cutinase til at nedbryde cutin-barrieren og passende næringsstoffer i blade.
"Vi fandt nogle specifikke forskelle i PETase sammenlignet med cutinase i området af enzymet, hvor de kemiske reaktioner forekommer, kendt som det aktive websted. PETase har et mere åbent aktivt websted, for eksempel, " sagde Silveira. "Vi studerede enzymets molekylære bevægelser gennem computersimuleringer, den del, jeg bidrog mest til. Mens krystalstruktur, opnået ved røntgendiffraktion, statisk information, simuleringer gav os dynamisk information og sætter os i stand til at opdage hver aminosyres specifikke rolle i PET-nedbrydningsprocessen."
Fysikken i molekylets bevægelser skyldes elektrostatisk tiltrækning og frastødning af rigtig mange atomer og fra temperatur. Computersimuleringer gjorde det muligt for forskerne at forstå mere fuldstændigt, hvordan PETase binder og interagerer med PET.
"Vi opdagede, at PETase og cutinase har to forskellige aminosyrer på det aktive sted. Vi brugte derefter molekylærbiologiske procedurer til at producere mutationer i PETase med det formål at omdanne det til cutinase, " sagde Silveira.
"Hvis vi kunne gøre det, vi ville finde ud af, hvilke komponenter der gav den denne unikke egenskab ved at nedbryde PET. Imidlertid, til vores overraskelse, da vi forsøgte at undertrykke denne særlige aktivitet af PETase - ved at forsøge at omdanne PETase til cutinase - producerede vi en endnu mere aktiv PETase. Vi forsøgte at reducere dens aktivitet, og i stedet boostede vi det."
Flere computersimuleringer var påkrævet for at forstå, hvorfor den mutante PETase var bedre end den originale PETase. Modellering og simuleringer viste tydeligt, at ændringerne produceret i den originale PETase lettede enzymets binding til substratet. Denne binding afhænger både af geometri, med to molekyler, der passer sammen som nøgle og nøglehul, og på de termodynamiske faktorer, der er involveret i interaktionerne mellem de forskellige komponenter af enzymet og polymeren. Den elegante måde at beskrive dette på er, at den modificerede PETase har "større affinitet" til substratet.
Med hensyn til at opnå et enzym, der kan fordøje tonsvis af plastikaffald, studiet var en stor succes, men hvorfor PETase er PETase forbliver et mysterium.
 Varme artikler
Varme artikler
-
 3D-udskrivning af den første biomimetiske tungeoverflade nogensindeDen 3D -printede negative form viser huller til filiforme og fungiforme papiller. Kredit:University of Leeds Forskere har skabt syntetiske bløde overflader med tungelignende teksturer for første g
3D-udskrivning af den første biomimetiske tungeoverflade nogensindeDen 3D -printede negative form viser huller til filiforme og fungiforme papiller. Kredit:University of Leeds Forskere har skabt syntetiske bløde overflader med tungelignende teksturer for første g -
 Større end summen af dets deleArgonne-forskere kombinerer eksisterende teorier for at danne en mere generel teori om elektrokemi, der forudsiger uforklarlig adfærd. At gøre dette, forskerne studerede først alfa-manganoxid (vist he
Større end summen af dets deleArgonne-forskere kombinerer eksisterende teorier for at danne en mere generel teori om elektrokemi, der forudsiger uforklarlig adfærd. At gøre dette, forskerne studerede først alfa-manganoxid (vist he -
 Supermaterialer ud af mikrobølgeovnenKredit:CC0 Public Domain Ved hjælp af ikke-konventionelle metoder, Christina Birkel og hendes kolleger i Kemisk Institut ved TU Darmstadt producerer metallisk keramik og nye materialer til fremtid
Supermaterialer ud af mikrobølgeovnenKredit:CC0 Public Domain Ved hjælp af ikke-konventionelle metoder, Christina Birkel og hendes kolleger i Kemisk Institut ved TU Darmstadt producerer metallisk keramik og nye materialer til fremtid -
 Katalysator fremstillet af jern kan drive en vigtig reaktion for fremstilling af organiske forbindel…Keio University-forskere har fundet en måde at erstatte det dyre ædelmetal ruthenium (billedet) med en simpel jernkatalysator til carbon-hydrogen-alkylering af aromatiske ketoner med alkener. Kredit:S
Katalysator fremstillet af jern kan drive en vigtig reaktion for fremstilling af organiske forbindel…Keio University-forskere har fundet en måde at erstatte det dyre ædelmetal ruthenium (billedet) med en simpel jernkatalysator til carbon-hydrogen-alkylering af aromatiske ketoner med alkener. Kredit:S
- Militære projekter flytter grænser for fleksibel elektronik i billedteknologier
- Sådan oprettes en EMF-detektor
- Undersøgelse af glasovergangsdynamik i flydende polymer ved hjælp af røntgenstråler
- Hvordan man forbereder sig på Precalculus
- Sporingsslamstrømning for bedre spildevandsrensning og mere biogas
- Iridium-katalyserede Z-tilbageholdende asymmetriske allyliske substitutionsreaktioner


