Iridium-katalyserede Z-tilbageholdende asymmetriske allyliske substitutionsreaktioner
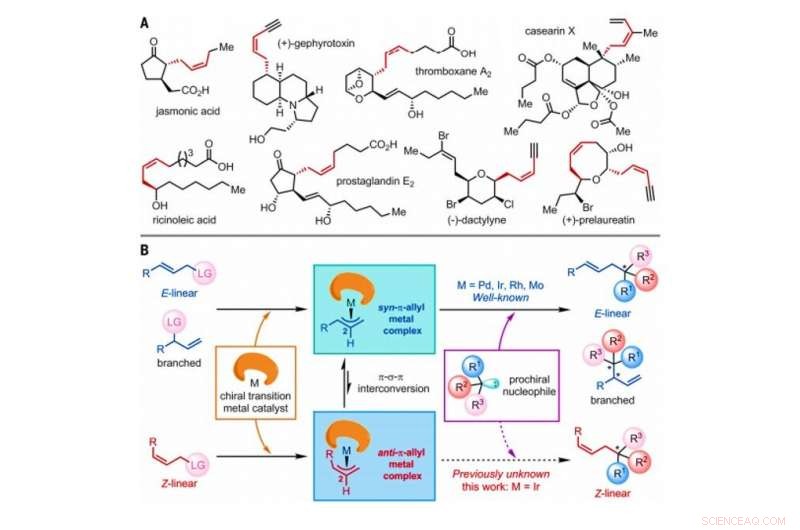
Strategi for konstruktion af Z-olefiner via asymmetriske allyliske substitutionsreaktioner katalyseret af overgangsmetalkatalysatorer. (A) Udvalgte naturlige produkter indeholdende Z-olefiner med homoallyliske stereocentre. Mig, methyl. (B) Foreslået generel mekanisme for overgangsmetalkatalyserede asymmetriske allyliske substitutionsreaktioner, der involverer E-lineær, forgrenet, eller Z-lineære olefinsubstrater, som alle omfatter et atom eller en gruppe af atomer betegnet som en fraspaltelig gruppe (LG). Kredit:Videnskab, doi:10.1126/science.abd6095
I syntetisk organisk kemi, Z-olefiner er et udfordrende syntetisk mål at producere i laboratoriet på grund af deres relative termodynamiske ustabilitet. Z-olefinerne danner en umættet forbindelse med et C n H 2n formel, der let kan isomeriseres. Analoge reaktioner, der bruges til at syntetisere optisk aktive Z-olefinprodukter, er sjældne. I en ny rapport nu offentliggjort den Videnskab , Ru Jiang og et forskerhold ved University of Chinese Academy of Sciences i Shanghai, Kina, detaljerede en iridiumkatalyseret asymmetrisk allylisk substitutionsreaktion for at bevare Z-olefingeometrier, mens der etableres et tilstødende kvaternært stereocenter. Holdet observerede dannelsen af forbigående anti-π-allyl-iridium-mellemprodukter og deres indfangning af eksterne nukleofiler (elektrondonor) før isomerisering for at danne termodynamisk mere stabile syn-π-allyl-iridium-modstykker. Resultaterne giver en lovende metode til fremstilling af chirale Z-olefinforbindelser i laboratoriet.
Olefiner
Den geometriske isomer af Z-typen af olefiner observeres bredt som grundlæggende strukturer i naturen. Alligevel, Z-olefiner er forholdsvis mindre stabile sammenlignet med deres modstykker af E-typen, og derfor, det er svært at selektivt syntetisere dem i organisk kemi. Almindelige metoder til adgang til Z-olefiner omfatter den fotoinducerede isomerisering af E-olefiner, Vidende olefination, Z-selektiv krydsmetatese, Z-retentiv krydskobling og den asymmetriske tilsætning af Z-allylboron-nukleofiler til ketoner og iminer. Z-olefinerne med et homoallylisk stereocenter er ofte indlejret i forskellige naturprodukter og bioaktive molekyler for at skabe betydelig interesse for syntetisk organisk kemi. Forskere har vist evnen til at udføre asymmetriske allyliske substitutionsreaktioner katalyseret af overgangsmetaller, herunder molybdæn (Mo), palladium (Pd), iridium (Ir) og rhodium (Rh). Siden den første rapport i 1997, Ir-katalyserede asymmetriske allyliske substitutionsreaktioner har vakt intens opmærksomhed på grund af deres usædvanligt høje regio- og enantioselektive karakter. I dette arbejde, Jiang et al. rapporterede reaktioner af Z-lineære allyliske substrater med tryptaminer og tryptophol. Under den omfattende analyse af reaktionsmekanismer, de bemærkede dannelsen af centrale anti-π-allyl-iridium-komplekser, før isomerisering for at danne de termodynamisk stabile syn-π-allyl-iridium-modstykker.
Substratomfang af Ir-katalyserede Z-tilbageholdende asymmetriske allyliske substitutionsreaktioner af indolderivater. Alle reaktioner blev udført i henhold til betingelserne angivet her, medmindre andet er angivet. Z-type til E-type geometrisk forhold (Z/E) og diastereomert forhold (dr) blev bestemt ved 1H NMR-analyse af de rå blandinger. De isolerede udbytter af Z-3 er rapporteret. Ee-værdierne blev bestemt ved højeffektiv væskekromatografi (HPLC) analyse med en kiral stationær fase. Stjernen angiver et Z/E -forhold på 7:1. Enkeltdolk-symbol angiver et Z/E-forhold på 8:1. Dobbelt dolk symbol angiver, at reaktionerne blev udført i 1 dag. Snitsymbolet angiver et Z/E -forhold på 11:1. Stiksymbol angiver, at reaktionerne blev udført ved hjælp af (Z) -on-2-en-1-yl acetat, [Ir (COD) Cl] 2 (3 mol %), (S) -L1 (6 mol %), InBr3 (1,0 ækv.), og tetrabutylammoniumbromid (0,5 ækv.) i CHC13 ved 0 ° C. Pund symbol angiver, at reaktionerne blev udført ved anvendelse af de tilsvarende Z-allyliske acetater, [Ir (COD) Cl] 2 (4,5 mol %), (S) -L2 (9 mol %), I (OTf) 3 (0,5 ækv. For Z-3aS og Z-3aT; 1 ækvivalent for Z-3aU) i CHCl3 ved −10 ° C i 2 dage. Bn, benzyl; Bu, butyl; Et, ethyl; Frk, mesyl; Ph, phenyl; PMB, para-methoxybenzyl; p-Tol, para-tolyl; Ts, tosyl. Kredit:Videnskab, doi:10.1126/science.abd6095 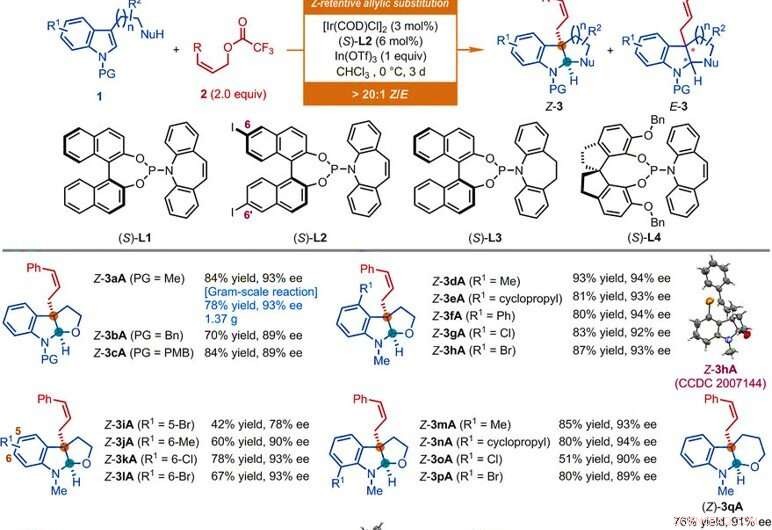
Forskerne undersøgte først den asymmetriske allyliske de-aromatiseringsreaktion, der involverede nukleofiler såsom N-methyltryptophol med Z-cinnamylderivater. Ved at bruge Z-cinnamylacetat, de opnåede den ønskede reaktion med en katalysator afledt af iridiumcyclooctadien (COD) chlordimer i nærvær af andre syntetiske forbindelser. Forskerne opnåede målproduktet med moderat udbytte og enantioselektivitet med et Z-type til E-type geometrisk forhold på 2:1. De optimerede derefter bestanddelene for at forbedre kvaliteten og udbyttet af de syntetiske produkter. Baseret på den foreslåede Z-retensive asymmetriske allyliske substitutionsreaktion, Jiang et al. opnået forskelligartet funktionel gruppekompatibilitet, der tolererede et bredt substratomfang. Holdet syntetiserede med succes mere end 50 eksempler på (homo) tryptophol, tryptaminer og indolsubstrater, der bærer en vedhængende carbonbaseret nukleofil ved hjælp af Z-cinnamylderivater. Næsten alle reaktioner gav et udbytte af forhold mellem Z-type og E-type større end 20:1. Eksempler omfatter de tilsvarende Z-cinnamylerede furoindoliner (forkortet Z-3aA til Z-3pA), tetrahydropyranindolin (forkortet Z-3qA), pyrroloindolines (forkortet Z-3a'A til Z-3o'A) og hexahydrocyclopentaindoles (forkortet Z-3a'′A til Z-3c′′A) med gode udbytter på op til 94 procent. Generelt, substitutionen af forskellige elektroniske og steriske egenskaber ved tilgængelige positioner i indolringen havde ingen skadelig indvirkning på reaktionens effektivitet eller enantioselektivitet. Forskerne etablerede produkternes strukturer og absolutte konfiguration ved hjælp af røntgenkrystallografisk analyse. De undersøgte derefter også ydelsen af D- og L-tryptophanderivaterne.
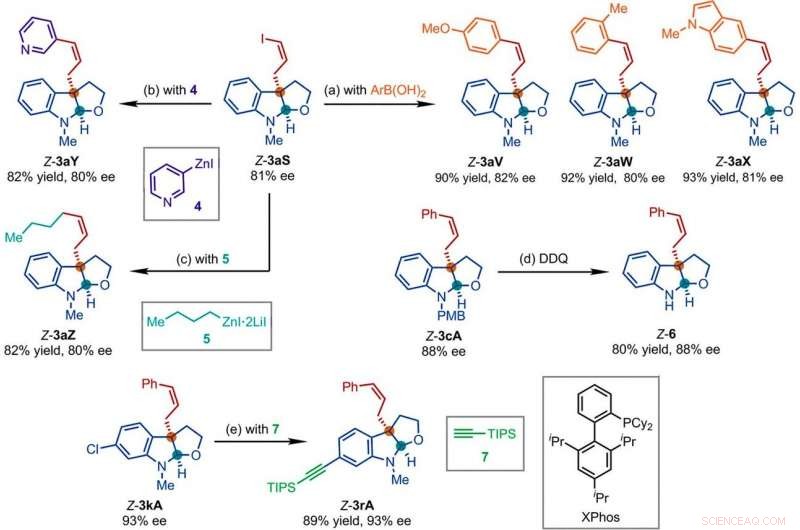
Repræsentative produkter opnået i efterfølgende reaktioner med produkterne fra Ir-katalyseret Z-tilbageholdende asymmetrisk allylisk substitutionsreaktion. Reaktionsbetingelser:(a) Pd (PPh3) 4 (0,5 mol %), Cs2CO3 (2 ækv.), ArB (OH) 2 (1,5 ækv.), acetonitril, 50 ° C; (b) 4 (2 ækv.), THF/diglyme (1:1), 110 ° C, 24 timer; (c) 5 (2 ækv.), LiCl (4 ækv.), toluen/THF/TMU, 110 ° C, 24 timer; (d) DDQ (1,5 ækv.), CH2Cl2, NaH2PO4 (vandig 1 M); (e) 7 (2 ækv.), PdCl2 (CH3CN) 2 (5 mol %), XPhos (15 mol %), Cs2CO3 (2,5 ækv.), acetonitril, 80 ° C. Ar, aryl; THF, tetrahydrofuran; TIPS, triisopropylsilyl; TMU, 1, 1, 3, 3-tetramethylurinstof. Kredit:Videnskab, doi:10.1126/science.abd6095
Nedstrøms transformationer
Forskerne undersøgte derefter, hvordan en række produkter fra den Z-retensive asymmetriske allyliske substitutionsreaktion let kunne undersøges i forskellige nedstrøms transformationer. For eksempel, Z-vinyliodidet af chirale furoindoliner (forkortet Z-3aS) var reaktivt over for arylboronsyrer og organozinkreagenser. This provided an alternative route to produce representative products with Ir-catalyzed, Z-retentive asymmetric allylic substitution reactions with high yields of up to 82 to 93%. The scientists evaluated the proposed Z-retentive asymmetric allylic substitution reactions by a series of analyses. They obtained the Z-cinnamylated furoindolines (Z-3aA) product with optimal results in the presence of iridium atoms in the catalyst in a molar ratio of 1:1. They then characterized the key intermediates in the catalytic cycle and elucidated their structures using nuclear magnetic resonance (NMR) spectroscopy alongside X-ray crystallographic analysis. The team also monitored the reactions using electrospray ionization mass spectrometry and mechanistic studies. These results showed the isomerization of the complex from an anti- to the syn-π-allyl-iridium complex. Collectively, the analyses showed how the proposed Z-retentive asymmetric allylic substitution reaction successfully originated from the rapid and enantioselective capture of the transient anti-π-allyl-iridium complex by external nucleophiles, before converting it to more thermodynamically stable species.
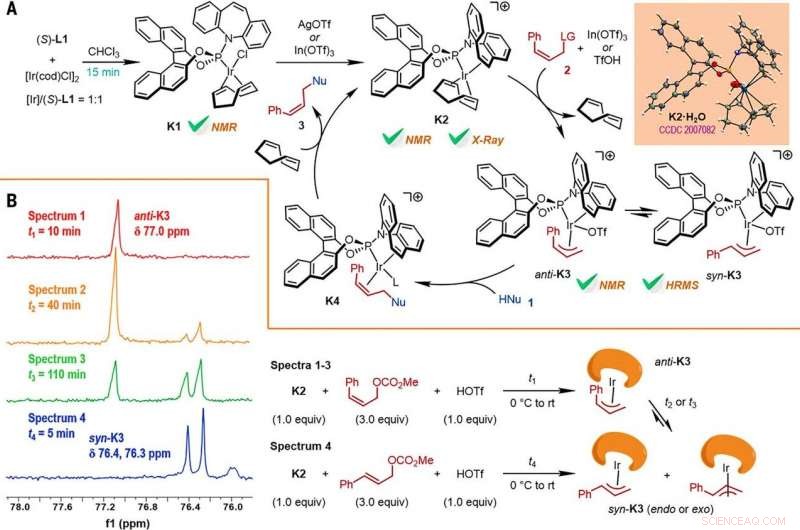
Reaction mechanism studies. (A) A proposed catalytic cycle. The key intermediates K1 and K2 were characterized by NMR spectroscopy, while K2•H2O was characterized by x-ray crystallographic analysis. HRMS, high-resolution mass spectrometry. (B) The reactions of K2 with Z- or E-cinnamyl methyl carbonate demonstrated isomerization from anti-K3 to syn-K3 according to the results of monitoring by electrospray ionization mass spectrometry (ESI-MS) and 31P NMR spectroscopy, the results of which are shown at left, with the details given by the reaction process diagrams to the right. Credit:Science, doi:10.1126/science.abd6095
Exploring the synthetic spectrum
The scientists also explored the extension of this iridium-catalyzed Z-retentive asymmetric allylic substitution reaction to other nucleophiles. Aside from the iridium catalysts containing Carreira-type chiral ligands that function under acidic conditions, they explored Ir catalysts derived from a Feringa-type chiral phosphoramidite ligand applied under basic conditions for this reaction mode. Som resultat, Jiang et al. used diverse nucleophiles beyond tryptophols and tryptamines. I dette tilfælde, they formed the prochiral nucleophiles from a copper (Cu) source. The independently prepared chiral cyclometallated Ir complex promoted the development of the transient anti-π-allyl-iridium complexes as well as their regio- and enantio-selective captures. The broad scope of the reaction presented more than 30 synthetic samples in good yields with excellent enantioselectivity. The scientists investigated the structure and absolute configuration of the products using X-ray crystallographic analyses. When the team used Z-cinnamyl acetate, they obtained a mixture of the desired Z-cinnamylated product and its branched isomer. The results highlighted the possibility of using the proposed protocol to accommodate diverse prochiral nucleophiles in asymmetric allylic substitution reactions. The researchers expect the work to evolve into a broadly practical method to synthesize chiral Z-olefins in the lab.
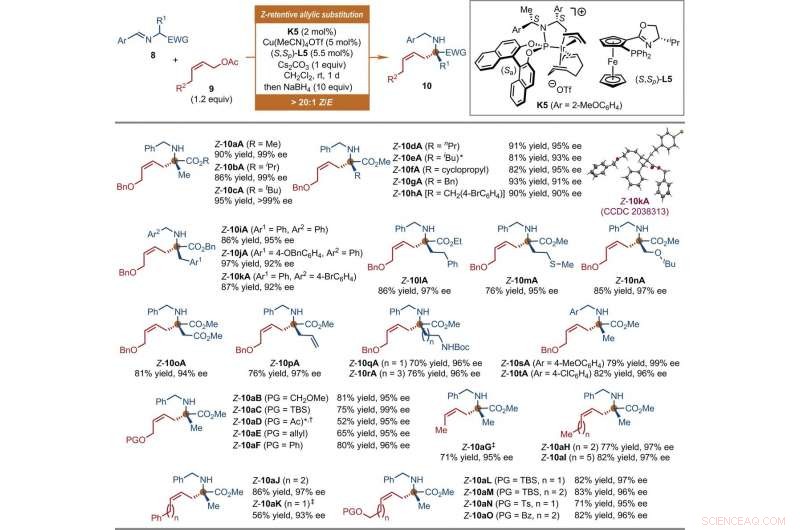
Substrate scope of Ir-catalyzed Z-retentive asymmetric allylic substitution reactions of a-amino acid derivatives. All reactions were conducted under the following conditions. Step 1:8 (0.2 mmol, 1 equiv), 9 (1.2 equiv), K5 (2 mol %), Cu(MeCN)4OTf (5 mol %), (S, Sp)-L5 (5.5 mol %), and Cs2CO3 (1 equiv) in CH2Cl2 (2 ml) at room temperature. Step 2:Reaction residue of step 1, NaBH4 (10 equiv) in CH2Cl2/MeOH (1:1, 4 ml) at room temperature. The Z-type to E-type geometric ratio (Z/E) values were determined by 1 H NMR analysis of the crude mixtures of step 1. The isolated yields of linear Z-10 are reported. The ee values were determined by HPLC analysis with a chiral stationary phase. The asterisk indicates that 9 (1.5 equiv) and K5 (4 mol %) were used. The single-dagger symbol indicates a Z/E ratio of 5.3:1. The double-dagger symbol indicates that 9 (2 equiv) was used. Ac, acetyl; Boc, tert-butoxycarbonyl; Bz, benzoyl; EWG, electron-withdrawing group; PG, protecting group; Pr, propyl; TBS, tert-butyldimethylsilyl. Credit:Science, doi:10.1126/science.abd6095
© 2021 Science X Network
Sidste artikelNyt materiale viser sig at afsalte vand mere effektivt
Næste artikelElastomerer udvikler stærkere bindingsbindinger
 Varme artikler
Varme artikler
-
 Tang:Fra superfood til superlederForskere har skabt porøse æggekasse-strukturerede nanofibre ved hjælp af tangekstrakt. Kredit:American Chemical Society Tang, de spiselige alger med en lang historie i nogle asiatiske køkkener, og
Tang:Fra superfood til superlederForskere har skabt porøse æggekasse-strukturerede nanofibre ved hjælp af tangekstrakt. Kredit:American Chemical Society Tang, de spiselige alger med en lang historie i nogle asiatiske køkkener, og -
 Syntetiske receptorer kan omkoble cellefunktioner og minimere bivirkningerKredit:CC0 Public Domain En af udfordringerne ved moderne farmakologi er specificitet. På trods af terapeutiske virkninger, medicin kan ofte have bivirkninger. Det biologiske grundlag for dette ha
Syntetiske receptorer kan omkoble cellefunktioner og minimere bivirkningerKredit:CC0 Public Domain En af udfordringerne ved moderne farmakologi er specificitet. På trods af terapeutiske virkninger, medicin kan ofte have bivirkninger. Det biologiske grundlag for dette ha -
 Bakterier kaprer konkurrentens latente fagSom viruspartikler, fager inficerer bakterier for at sikre deres egen fremgang. Kredit:Thomas Böttcher Denne målrettede kontrol med fager giver helt nye bioteknologiske og terapeutiske tilgange, f
Bakterier kaprer konkurrentens latente fagSom viruspartikler, fager inficerer bakterier for at sikre deres egen fremgang. Kredit:Thomas Böttcher Denne målrettede kontrol med fager giver helt nye bioteknologiske og terapeutiske tilgange, f -
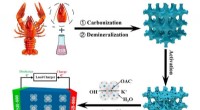 Affald til skat:Krebseskaller til at lagre energiSkematisk diagram over fremstilling af HPCer med tung bioolie (HB) assisteret af krebsskaller. Kredit:Luo Zejun et al Mere end bare en krydret natsnack, krebsen er blevet udstyret med større betyd
Affald til skat:Krebseskaller til at lagre energiSkematisk diagram over fremstilling af HPCer med tung bioolie (HB) assisteret af krebsskaller. Kredit:Luo Zejun et al Mere end bare en krydret natsnack, krebsen er blevet udstyret med større betyd
- Forskere løser et stort mysterium inden for 2-D materialeelektronik
- "Dominant Allele: What is it?", 3, [[& Hvorfor sker det? (med trækdiagram)
- Brug af syntetisk biologi til klamydiavacciner
- Hvordan man identificerer Mason Wasps
- Udtalelse:Giv kaution til udømte fanger for at stoppe spredningen af coronavirus
- Forskere frigiver køreplan for risikostyring til atomkernen i Nordkorea


