Kerneelektrontopologier i kemisk binding
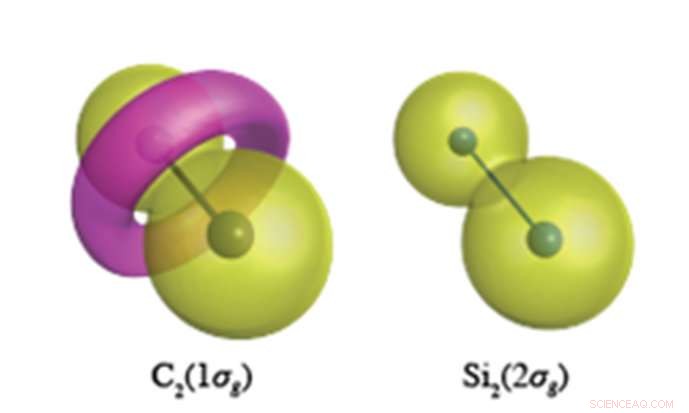
Indre kerneelektroner forventes at have en jordnøddelignende bølgefunktion som vist for Si 2 s elektroner (højre). I C-C-bindingen, imidlertid, C1s-elektronerne danner et torus-lignende træk med modsat polaritet, vist i pink i venstre figur. Kredit:Yokohama National University
YNU-forskere har løst det ældgamle mysterium om, hvorfor silicium ikke kan erstatte kulstof i organiske forbindelser. En ny benchmark kvantekemisk beregning af C 2 , Si 2 , og deres hydrider afslører en kvalitativ forskel i topologierne af kerneelektronorbitaler af organiske molekyler og deres siliciumanaloger. Forskerne foreslår andre elementer med kulstofs tilbøjelighed til at omforme deres kerneelektronknudestrukturer ved kemisk binding.
Siden opdagelsen af silicium og Wöhlers succes i midten af det 19. århundrede med at syntetisere organiske forbindelser, Wöhler var selv blandt de første, der foreslog at erstatte kulstof med silicium i organiske forbindelser. Det blev klart i begyndelsen af det 20. århundrede, at silicium ikke har en kemi, der ligner kulstof, og drømme om siliciumbaseret liv overlever kun i science fiction. Vi ved empirisk, at kulstof har evnen til at danne en række umættede forbindelser, hvilket silicium ikke gør. Imidlertid, årsagen til, hvorfor kun kulstof har denne evne, er forblevet et mysterium.
Kvantekemiske beregninger af hidtil uset nøjagtighed udført på YNU afslører, at kerneelektroner (som ikke skulle deltage i kemisk binding) har en meget anderledes rolle i de umættede forbindelser af kulstof og silicium. Kulstof har tilbøjelighed til at ændre topologien (knudestrukturen) af dets kerneelektroner, hvilken, for C 2 , resulterer i dannelsen af en torus-lignende ring i 1σg orbital dannet af C1s elektroner (se figur). Si 2 , imidlertid, opretholder de sfæriske-lignende kerneorbitaler centreret på hvert atomare sted i alle dets molekyler. Denne fleksibilitet af carbons kerneorbitaler gør det muligt for carbon at danne et overflødighedshorn af forskellige valensbindingsstrukturer, hvorimod silicium er begrænset til bindingsstrukturer ortogonale i forhold til de atomare lignende sfæriske kerneorbitaler.
Virkningen af denne opdagelse er vidtrækkende. Kerneelektroner er hidtil blevet antaget mere eller mindre inerte, men måske bliver det nødvendigt at revurdere deres bidrag til kemisk binding - i det mindste i tilfælde af umættede bindinger. Endelig, undersøgelsen tyder på, at andre elementer, såsom nitrogen, fosfor, og fluor, udviser lignende fleksibilitet til at ændre deres kerneelektrontopologier, og dermed, udviser tilsvarende rig kemi.
Papiret, "Kerneelektrontopologier i kemiske forbindelser:Casestudie af kulstof versus silicium, " er offentliggjort i Angewandte Chemie International Edition bind 57(24) den 6. juni, 2018.
 Varme artikler
Varme artikler
-
 Hvorfor er destilleret vand en god kontrol til videnskabsprojekter?Hovedårsagen til, at destilleret vand tilbyder det bedste valg til brug i videnskabsprojekter, er, at det er inert, hvilket betyder, at der næsten intet bliver tilbage i vandet efter destillering.
Hvorfor er destilleret vand en god kontrol til videnskabsprojekter?Hovedårsagen til, at destilleret vand tilbyder det bedste valg til brug i videnskabsprojekter, er, at det er inert, hvilket betyder, at der næsten intet bliver tilbage i vandet efter destillering. -
 Ny metode til konstruktion af metaboliske vejeKredit:CC0 Public Domain Celler er utroligt dygtige til at skabe komplekse molekyler, ligesom terapi, og kan gøre så meget bedre end mange af vores bedste fabrikker. Syntetiske biologer søger at
Ny metode til konstruktion af metaboliske vejeKredit:CC0 Public Domain Celler er utroligt dygtige til at skabe komplekse molekyler, ligesom terapi, og kan gøre så meget bedre end mange af vores bedste fabrikker. Syntetiske biologer søger at -
 Forskere designer udvindingsmidler til sjældne jordarter ved hjælp af ny softwareKredit:Ames Laboratory U.S. Department of Energys Critical Materials Institute har udviklet et computerprogram, kaldet ParFit, som i høj grad kan reducere mængden af tid brugt på at identificere
Forskere designer udvindingsmidler til sjældne jordarter ved hjælp af ny softwareKredit:Ames Laboratory U.S. Department of Energys Critical Materials Institute har udviklet et computerprogram, kaldet ParFit, som i høj grad kan reducere mængden af tid brugt på at identificere -
 DNA origami mere modstandsdygtig end tidligere forståetDNA origami nanostrukturer (grønne trekanter) overlever, selvom magnesiumkoncentrationen er drastisk reduceret fra fremstillingsbetingelser. Kredit:Boxuan Shen og Veikko Linko DNA origami -teknikk
DNA origami mere modstandsdygtig end tidligere forståetDNA origami nanostrukturer (grønne trekanter) overlever, selvom magnesiumkoncentrationen er drastisk reduceret fra fremstillingsbetingelser. Kredit:Boxuan Shen og Veikko Linko DNA origami -teknikk
- Tidlig smeltning af vintersnefald fremmer det arktiske forår
- Elektron-par opdagelse fremmer felt af kvantematerialer
- Én milliard soler:Verdens lyseste laser gnister ny adfærd i lys
- Bedre batterier gennem nanoskala 3D kemisk billeddannelse
- Amerikansk dommer anbefaler delvist forbud mod import af iPhone til USA (Opdatering)
- Klimaændringer er en trussel mod Afrikas transportsystemer:Hvad skal der gøres


