Super-opløsning billeddannelse afslører mekanisme af GLUT1 klyngedannelse
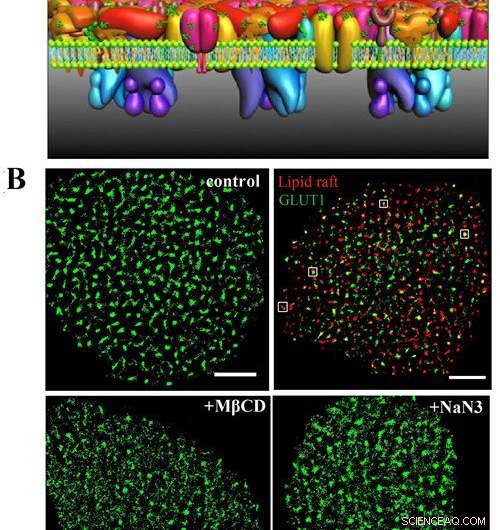
A) Dette er PLLPI-modellen af cellemembranen. B) dSTORM-billeder af GLUT1 på cellemembranen; GLUT1 og lipid rafts; og GLUT1-fordeling efter MβCD- og NaN3-behandling. Skala barer, 5 μm. Kredit:GAO Jing
Glukose er den primære energikilde og substrat for celler, og dets optagelse gennem celleplasmamembranen er i høj grad afhængig af glukosetransportfamilien (GLUT). GLUT1, et af GLUT-familiemedlemmerne, er et allestedsnærværende udtrykt membranprotein. Det er ansvarligt for den konstante optagelse af glukose i mange væv.
Yan et al. rapporterede krystalstrukturen af humant GLUT1 ved en opløsning på 3,2 ångstrøm i 2014. Dog, den detaljerede fordeling af GLUT1 på native cellemembraner var ikke klar, og hvordan proteinorganisationer knytter sig til deres fysiologiske funktioner forblev ukendt. Med modifikation og opdatering af cellemembranstruktur, mange undersøgelser har fundet den heterogene og klyngefordeling af membranproteiner.
En nylig proteinlag-lipid-protein-ø (PLLPI) membranmodel understregede, at et tæt proteinlag dannedes på den ektoplasmiske side af membranen og dispergerede proteinmikrodomæner dannet på den cytoplasmiske side. For at adressere distributionskarakteristika og de underliggende organisationsmekanismer af GLUT1, super-resolution fluorescensmikroskopi har givet et særligt egnet værktøj. Det bryder diffraktionsbarrieren og opnår en lateral opløsning i titusvis af nanometer. Det er meget velegnet til direkte overvågning af størrelsen og stabiliteten af proteinaggregationer.
Prof. WANG Hongda fra Changchun Institute of Applied Chemistry, Chinese Academy of Sciences og prof. XIONG Wenyong fra Kunming Institute of Botany, sammen med deres teammedlemmer, undersøgte først distributionen og samlingen af GLUT1 ved en nanometeropløsning ved direkte stokastisk optisk rekonstruktionsmikroskopi (dSTORM).
De fandt ud af, at transportøren dannede klynger med en gennemsnitlig diameter på ~250 nm på HeLa-cellemembraner. Der var en præcis rumlig sammenhæng mellem GLUT1 og lipid-flåder, som løste debatten omkring lokaliseringen af transportøren i membrandomæner.
Med hensyn til den organisatoriske mekanisme af GLUT1-klynger, de afslørede, at ikke kun kan lipidflådernes miljø stabilisere deres eksistens, men actincytoskelet og N-glykosylering spiller også vigtige roller i klyngernes dannelse.
I øvrigt, de fandt, at aktiveringen af GLUT1 med natriumazid eller MβCD ikke øgede dets membranekspression, men inducerede faldet af de store klynger.
Resultaterne antydede en potentiel sammenhæng mellem distribution og aktivering. Deres teams arbejde kan udgøre et skridt fremad i vores forståelse af den molekylære mekanisme af GLUT-klynger og glukoseoptagelse.
 Varme artikler
Varme artikler
-
 Rekonstitueret silke kan være flere gange stærkere end den naturlige fiber og fremstillet i forske…Et fotografi viser regenererede spiralformede silkefibre farvet af Rhodamine farvestoffer, under UV-lys. Kredit:Massachusetts Institute of Technology Når det kommer til at lave den komplekse bland
Rekonstitueret silke kan være flere gange stærkere end den naturlige fiber og fremstillet i forske…Et fotografi viser regenererede spiralformede silkefibre farvet af Rhodamine farvestoffer, under UV-lys. Kredit:Massachusetts Institute of Technology Når det kommer til at lave den komplekse bland -
 Hurtigere, billigere spildevandsrensning gennem forbedrede oxidationsreaktionerUC Riverside-forskere har vist, at tilføjelse af en billig co-katalysator dramatisk kan forbedre hastigheden og effektiviteten af Advanced Oxidation Processes (AOPer). Kredit:UC Riverside Forske
Hurtigere, billigere spildevandsrensning gennem forbedrede oxidationsreaktionerUC Riverside-forskere har vist, at tilføjelse af en billig co-katalysator dramatisk kan forbedre hastigheden og effektiviteten af Advanced Oxidation Processes (AOPer). Kredit:UC Riverside Forske -
 Bygger broer inden i cellen - ved hjælp af lysProteiner er byggestenene i broen mellem organeller i cellen. Kredit:Yun Huang og Yubin Zhou Hver celle i kroppen består af et antal små forseglede membranøse underenheder kaldet organeller, og de
Bygger broer inden i cellen - ved hjælp af lysProteiner er byggestenene i broen mellem organeller i cellen. Kredit:Yun Huang og Yubin Zhou Hver celle i kroppen består af et antal små forseglede membranøse underenheder kaldet organeller, og de -
 Almindelig herbicidforbindelse kan redde millioner af livUQ -ph.d. -studerende Mario D. Garcia udfører et af de mange eksperimenter, der er involveret i forskningen. Kredit:University of Queensland En kemisk forbindelse, der findes i almindelige herbici
Almindelig herbicidforbindelse kan redde millioner af livUQ -ph.d. -studerende Mario D. Garcia udfører et af de mange eksperimenter, der er involveret i forskningen. Kredit:University of Queensland En kemisk forbindelse, der findes i almindelige herbici
- Har lys som en fjer,
- San Francisco har sin helt egen synk,
- Hvad er det næste for smarte hjem:Et internet af ører?
- Termiske stød ved høje temperaturer øger stabiliteten af enkeltatom-katalysatorer
- Forskere udvikler holografiteknologi, der kan ændre den måde, vi ser verden på
- Watchdog:Vestlig teknologi brugt til hacking i Tyrkiet, Syrien


