Opdagelsen af et nyt køretøjspeptid åbner en rute til levering af lægemidler
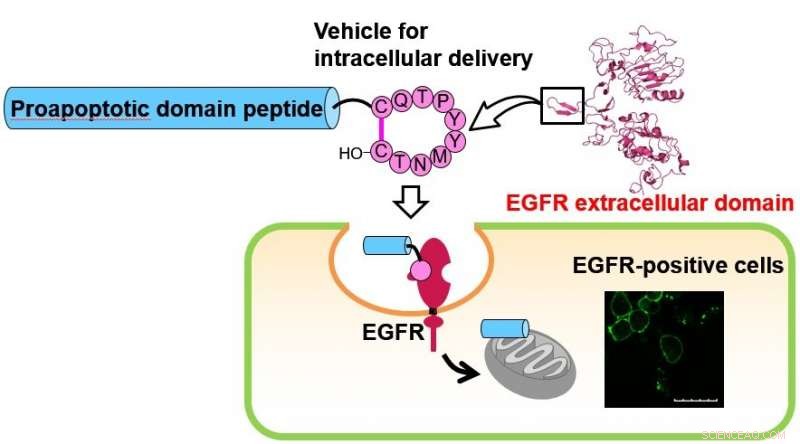
Cyklisk decapeptid, som efterligner dimeriseringsarmen af EGF-receptoren (EGFR), blev tidligere fundet at være fanget i celler. Forfatterne har fundet det lovende potentiale for dette peptid som en intracellulær leveringsvehikel rettet mod EGFR-positive celler. Den cellulære levering af det proapoptotiske domæne (PAD) peptid blev udfordret ved konjugering med det ovennævnte cykliske peptid. Den cellulære optagelse af det konjugerede peptid, som var sammensat af det cykliske peptid, PAD-peptidet og en linker, der kan spaltes med en protease, blev evalueret ved behandling af EGFR-positive celler. Signifikant undertrykkelse af proliferation af det konjugerede peptid blev vist i et cellelevedygtighedsassay. Kredit:Institut for Medicinalkemi, TMDU
Inden for kræftbehandling, kationiske antimikrobielle peptider (AMP'er) har vundet fremtrædende plads på grund af deres cytotoksiske og anticanceraktivitet i lægemiddelresistente cancerceller. Peptider er forbindelser, der består af to eller flere aminosyrer forbundet i en kæde.
Et membranimpermeabelt proapoptotisk domæne (PAD) peptid [KLAKLAK]2 er kendt for at være et antimikrobielt middel og forårsage mitokondriel membranafbrydelse, efterfulgt af celledød. De fleste AMP'er inklusive PAD har antitumorfunktioner på grund af et multifunktionelt værtsforsvarssystem af flercellede organismer; imidlertid, de kan ikke trænge ind i cellemembraner, og alene, de har ringe cytotoksicitet.
Tidligere undersøgelser har vist, at PAD-peptider trænger ind i celler ved deres konjugation med cellegennemtrængende peptider (CPP'er). Et hold af Tokyo Medical and Dental University (TMDU) forskere har vist et cyklisk decapeptid, kaldet peptid 1, efterligner dimeriseringsarmen på EGF -receptoren (EGFR). EGFR er involveret i cellulære signaltransduktioner og kræftprogression, og er overudtrykt i mange kræftceller. Derfor, binding af peptid 1 til EGFR kunne potentielt hæmme cancervækst.
I sin seneste undersøgelse, holdet havde til formål at verificere selektiviteten af peptid 1 til EGFR og undersøgte dets effektivitet som en vehikel til intracellulær levering til celler. Forskerne rapporterede deres undersøgelse i Biokonjugatkemi .
"Som en proof-of-concept undersøgelse, den cellulære levering af PAD -peptidet blev udfordret ved konjugering med peptid 1, ", forklarer førsteforfatter Kei Toyama. "Den cellulære optagelse af et konjugeret peptid 2, sammensat af peptid 1, PAD-peptidet, og en linker, der kan spaltes med en protease, blev evalueret ved behandling af en EGFR-positiv lungekræftcellelinje. "
Signifikant undertrykkelse af proliferation af peptid 2 blev observeret i cellelevedygtighedsassays, hvorimod konjugat 3, som ikke indeholder peptid 1, havde ingen signifikant inhiberende aktivitet i cellelinjerne. Især PAD -peptidet alene havde ingen effekt på cellerne.
"Vores resultater tyder på, at peptid 1 er en lovende hovedforbindelse som en ny intracellulær leveringsvehikel til terapeutisk effektive peptider, " siger seniorforfatter Hirokazu Tamamura. "Også, konjugat 2, med dens apoptose-induktionsaktivitet, kan udforskes som et nyt apoptotisk peptid, der kunne bidrage til udviklingen af anticancerreagenser baseret på AMP-funktionerne."
 Varme artikler
Varme artikler
-
 disker op med 3D-printet mad, en velsmagende udskrift ad gangenRepræsentative billeder af 3D-printede former med fem formuleringer af en fødevareblæktype, billeder med boks tegnet rundt om dem repræsenterer de optimerede formuleringer af blækket. Udskriv scorer r
disker op med 3D-printet mad, en velsmagende udskrift ad gangenRepræsentative billeder af 3D-printede former med fem formuleringer af en fødevareblæktype, billeder med boks tegnet rundt om dem repræsenterer de optimerede formuleringer af blækket. Udskriv scorer r -
 Skiller sig ud:Usædvanlig magnetisk overgang i perovskitoxid kan hjælpe med at øge spintronicsForskere fandt ud af, at PbFeO3 krystalliserede til en enestående tilstand, hvor et lag bestående af Pb2+ -ioner blev sammenflettet af to lag omfattende en blanding af Pb2+ og Pb -ioner i et 3:1 -forh
Skiller sig ud:Usædvanlig magnetisk overgang i perovskitoxid kan hjælpe med at øge spintronicsForskere fandt ud af, at PbFeO3 krystalliserede til en enestående tilstand, hvor et lag bestående af Pb2+ -ioner blev sammenflettet af to lag omfattende en blanding af Pb2+ og Pb -ioner i et 3:1 -forh -
 Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden
Molekylære vibrationer reducerer den maksimalt opnåelige fotovoltage i organiske solcellerIllustration af generation af ladningspar (excitoner), forløberne til gratis ladningsbærere i det aktive lag af en organisk solcelle. Kredit:Technische Universitaet Dresden Forskere ved TU Dresden -
 En metode til computerstøttet modellering og simulering af store proteiner og andre biomolekylerKredit:CC0 Public Domain To computerforskere ved Freie Universität Berlin ændrer måden, store proteiner modelleres inde i computere ved at kombinere maskinlæring, et område med kunstig intelligens
En metode til computerstøttet modellering og simulering af store proteiner og andre biomolekylerKredit:CC0 Public Domain To computerforskere ved Freie Universität Berlin ændrer måden, store proteiner modelleres inde i computere ved at kombinere maskinlæring, et område med kunstig intelligens
- Her er planen for et globalt ildkugleobservatorium - og hvorfor vi har brug for et
- Screen kunne tilbyde bedre sikkerhedstests for nye kemikalier
- Nøglemedarbejdernes dedikation tager hårdt på deres familier:Hvad arbejdsgivere skal gøre for at…
- Førstehjælpskasse i nogle levende organismer hjælper med at fikse DNA efter længere tids soleksp…
- Forskere finder en kemisk løsning til at skrumpe digital datalagring
- Plantning af træer for at redde planeten:Den kinesiske oplevelse


