CryoEM-undersøgelse fanger opioid-signalering i handling
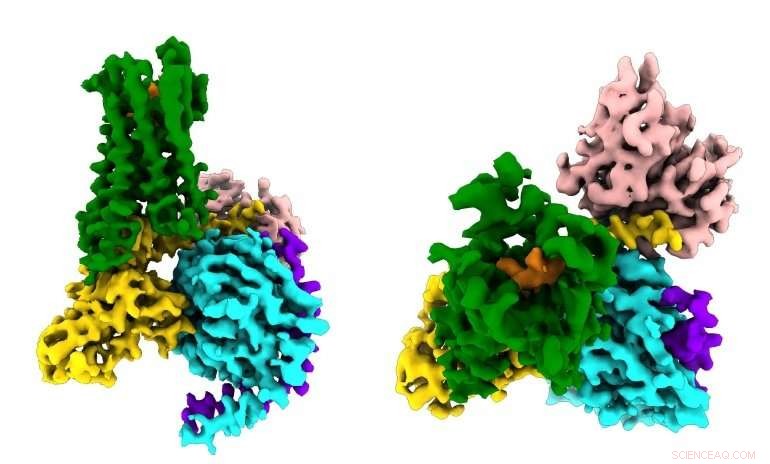
Forskere ser for første gang, hvordan et syntetisk opioidlægemiddel (orange) binder sig til µ-opioidreceptorerne (grønne) i hjernen, og aktivere signalmolekyler i neuroner (G⍺s i guld, Gβ i cyan, Gγ i lilla), der fører til smertelindring og afhængighed. Kredit:Antoine Koehl (Manglik lab)
Opioidmedicin som morfin og fentanyl er en grundpille i moderne smertemedicin. Men de forårsager også forstoppelse, er meget vanedannende, og kan føre til dødelig respirationssvigt, hvis den tages i for høj dosis. Forskere har længe søgt at udvikle nye opioider, der kan drive smerte væk uden disse farlige bivirkninger, men huller i vores forståelse af, hvordan opioider udøver deres forskellige virkninger på biologisk plan, har hidtil holdt denne drøm i skak.
Opioide smertestillende midler virker ved at binde til et receptorprotein, der er til stede på nerveceller kaldet µ-opioidreceptoren, som udviklede sig til at reagere på kroppens naturlige smertestillende midler (såsom endorfiner produceret ved træning) ved at dæmpe smerter og skabe en følelse af eufori. Opioide stoffer fra opium til morfin til heroin kaprer dette signalsystem ved at binde sig til det samme receptormolekyle. Men detaljer om, hvordan aktivering af disse receptorer udløser stoffernes positive og negative virkninger, er forblevet uklare.
Nu, i en undersøgelse offentliggjort den 13. juni, 2018 i Natur , forskere ved UC San Francisco og Stanford University har brugt ultrahøj opløsning kryo-elektronmikroskopi (cryoEM) til at fange det mest detaljerede portræt nogensinde af et opioidlægemiddel, der udløser den biokemiske signalkaskade, der giver den sin magt-både på godt og ondt .
"Vi har hovedsageligt fanget denne signalhændelse på gerningen, " sagde studiets co-senior forfatter Aashish Manglik, MD, Ph.D., en assisterende professor i farmaceutisk kemi på UCSF's School of Pharmacy, der udførte det nye studie som kandidatstuderende og Distinguished Fellow ved Stanford. "Disse nye billeder på atomniveau vil forhåbentlig gøre os i stand til rationelt at designe forbindelser, der målretter mod forskellige aspekter af opioidsignalering i hjernen, med håb om at identificere nye, sikrere smertestillende midler. "
Μ-opioidreceptoren er en del af en stor familie på hundredvis af signalproteiner kaldet G-proteinkoblede receptorer (GPCR'er), der er involveret i alt fra syn og hørelse til immunsystemets reaktion på invasive patogener, og er mål for mere end 30 procent af moderne lægemidler. De fleste GPCR'er deler de samme grundlæggende mekanismer:Når det rigtige signalmolekyle (f.eks. et opioid) binder til en GPCR på ydersiden af cellen, proteinet stimulerer en kædereaktion af biokemiske signaler i cellen ved at aktivere et messengermolekyle kaldet et G -protein (deraf navnet GPCR).
Eksperimenter, der afslørede, hvordan en anden type GPCR binder til det "stimulerende" G-protein, førte til en Nobelpris til Stanfords Brian Kobilka, MD, en af seniorforfatterne til den nye undersøgelse, men forskere har i årtier vidst, at GPCR'er også kan binde sig til så mange som et dusin andre signalmolekyler i cellen. For eksempel, µ-opioidreceptorer aktiverer typisk kun såkaldte "hæmmende" G-proteiner, som har den modsatte effekt af den stimulerende G-proteinkaskade. Imidlertid, videnskabsmænd er ikke sikre på, hvad der forårsager nogle GPCR'ers affinitet til bestemte partnerproteiner i cellen, eller præcis hvad konsekvenserne er.
Forskere håber, at ved at forstå disse forskellige veje for GPCR-signalering, de kan være i stand til at udvikle lægemidler med meget specifikke virkninger, såsom at undertrykke smerte uden at forårsage afhængighed. Men indtil nu, forskere anede ikke, hvordan en given GPCR selektivt interagerer med kun en undergruppe af signalpartnere i cellen.
Den nye undersøgelse, offentliggjort 13. juni, 2018 i Natur , fangede for første gang, hvordan µ-opioidreceptoren binder til sin inhiberende G-proteinpartner. Blandt andre fund, undersøgelsen viste, at receptorens selektivitet synes at skyldes den lille størrelse af bindingslommen for G-proteinet på indersiden af cellen, der henviser til, at det stimulerende G -protein kræver et større bindingssted.
Manglik har tidligere samarbejdet med Brian Shoichets computerforskningslaboratorium. Ph.D., en professor i farmaceutisk kemi ved UCSF's School of Pharmacy, at identificere et molekyle kaldet PZM21, der tillader µ-opioidreceptoren kun at engagere det hæmmende G-protein, men ikke et andet signalmolekyle kaldet beta-arrestin, og viste, at dette selektive lægemiddel gav smertelindring med reducerede bivirkninger hos mus. Hans laboratorium bygger nu på det nye, portræt af opioidreceptor i høj opløsning - G -proteinkompleks for at udvikle nyt, endnu mere selektive forbindelser.
 Varme artikler
Varme artikler
-
 Skinner lys over den underlige verden af dihydrogenphosphatanionerRepræsentation, der viser dihydrogenphosphater (i grønt), der binder sammen i opløsning. Kredit:UNSW Forskere ved UNSW Sydney, sammen med samarbejdspartnere fra Western Sydney University og Hollan
Skinner lys over den underlige verden af dihydrogenphosphatanionerRepræsentation, der viser dihydrogenphosphater (i grønt), der binder sammen i opløsning. Kredit:UNSW Forskere ved UNSW Sydney, sammen med samarbejdspartnere fra Western Sydney University og Hollan -
 Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek
Nysgerrige sammenlåste molekyler viser dobbelt responsFigur 1. Skematisk illustration af driften af en rotaxan-baseret mekanophor, viser (a) kraftfri tilstand, (b) reversibel, og (c) irreversible svar. Forskere udforskede en mærkelig sammenkoblet molek -
 Anvendelse af carbidOrdet carbide betegner en forbindelse af carbon og et andet element eller elementer. Når udtrykket bruges af sig selv, refererer det normalt til calciumcarbid, eller undertiden, wolframcarbid. Andre t
Anvendelse af carbidOrdet carbide betegner en forbindelse af carbon og et andet element eller elementer. Når udtrykket bruges af sig selv, refererer det normalt til calciumcarbid, eller undertiden, wolframcarbid. Andre t -
 Hvis bare A.I. havde en hjerne - ingeniører modellerer en kunstig synapse efter den menneskelige hj…Pitt-ingeniører byggede en grafen-baseret kunstig synapse i en todimensionel, bikage -konfiguration af kulstofatomer, der viste fremragende energieffektivitet, der kan sammenlignes med biologiske syna
Hvis bare A.I. havde en hjerne - ingeniører modellerer en kunstig synapse efter den menneskelige hj…Pitt-ingeniører byggede en grafen-baseret kunstig synapse i en todimensionel, bikage -konfiguration af kulstofatomer, der viste fremragende energieffektivitet, der kan sammenlignes med biologiske syna
- 699 tons SLAC -accelerator fjernet til opgradering
- Avancerede genbrugsstrategier, der er nødvendige for at rydde op i plastikforureningsproblemet, sig…
- Stabilisering af jord med sulfater for at forbedre deres konstruktionsmæssige egenskaber
- Kulstofafgiften, der ville efterlade husholdningerne bedre
- Australier slår verdensrekord med Everest-topmødet
- Opdager og krymper børsterne af polyelektrolytbørster


