Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundet
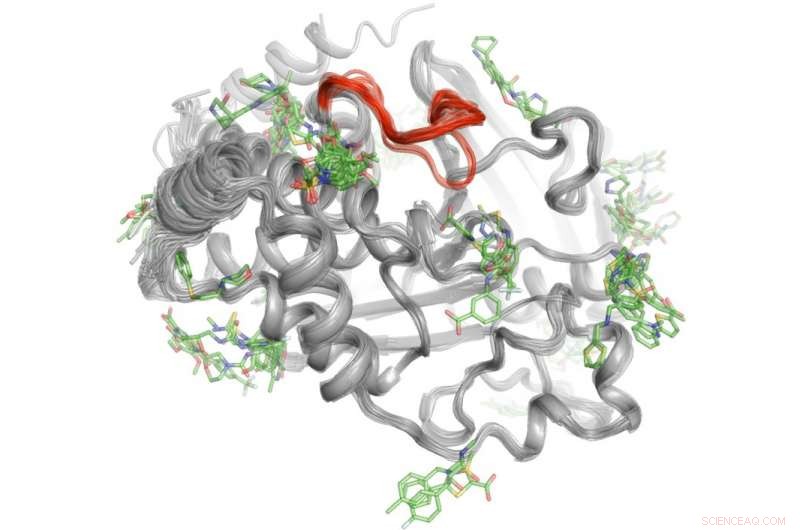
En high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs aktivitet. "Kredit:Daniel Keedy
Proteinerne i vores kroppe er sofistikerede strukturer, der udfører specifikke opgaver for at holde os velfungerende og sunde. I mange tilfælde, disse små maskiner tændes eller slukkes gennem en to-trins proces, hvor en del af proteinet sender beskeder til en anden del kaldet det "aktive sted, " udløser proteinet til at starte eller stoppe sit arbejde. Nogle gange forstyrres denne proces - kendt som allosteri, som fører til eller bidrager til udviklingen af visse sygdomme.
At forstå, hvordan et protein er kablet, kan hjælpe forskere med at udvikle måder at kontrollere dets aktivitet på, og videnskabsmænd ved Advanced Science Research Center (ASRC) ved The Graduate Center, CUNY, mener, at de har fundet på en pålidelig måde at bestemme dette på, ifølge en nyligt offentliggjort undersøgelse i eLife .
"Ligesom det er svært at gætte, hvordan en lyskontakt er forbundet til en pære i et rum uden at se bag væggene, det er svært at forudsige, hvilket fjerntliggende område af et protein, der er forbundet til dets aktive sted uden at se detaljerne inde i strukturen, "sagde Daniel Keedy, assisterende professor med ASRC's Structural Biology Initiative og med The City College of New Yorks kemi- og biokemiske afdelinger.
For at løse dette mysterium, Keedy og hans kolleger udforskede signalegenskaberne af proteintyrosinphosphatase 1B (PTP1B), som forskere mener spiller en væsentlig rolle ved type 2-diabetes og muligvis brystkræft. De brugte først røntgenkrystallografi ved forskellige temperaturer for at se, hvordan atomer inde i proteinet bevæger sig. Dette afslørede bestemte områder, hvor atomerne bevæger sig som vinduesviskere eller et Newtons vugge -legetøj for at sende beskeder. Næste, holdet udførte high-throughput eksperimenter med proteinet for at bestemme, hvilke små molekyler der binder til disse signalsteder.
"Denne to-trins proces gjorde det muligt for os ikke kun at se, hvor signaleringen stammer fra PTP1B, men også hvilke små molekyler der er i stand til at sende beskeder til det aktive sted. Denne viden kan en dag hjælpe os med at udvikle terapier, der sender specifikke budskaber til at kontrollere et proteins aktivitet og forstyrre udviklingen af type 2-diabetes, " sagde Keedy.
"Jeg er ret opsat på de mulige anvendelser af Daniels arbejde, sagde Kevin Gardner, direktør for ASRCs strukturbiologiske initiativ og Einstein professor i kemi og biokemi ved City College. "Denne teknik giver en kraftfuld eksperimentel vej til at spørge, hvor små molekyler kan binde sig til proteinmål, muliggør opdagelse og udvikling af lægemidler ved at vise, hvor man måske kan finde tidligere uforudsete 'fodfæste' for forbindelser til at binde og kontrollere proteinaktivitet. "
Keedy og hans kolleger har indtil nu kun set på PTP1B, men deres metode bruger let tilgængelige teknologier, der kan bruges til at studere processen med allosteri i mange andre vigtige proteiner i vores kroppe. De håber at få en ny forståelse af, hvordan funktionerne af disse andre proteiner styres, som kunne være nyttig til fremtidig udvikling af nye lægemiddelterapier.
 Varme artikler
Varme artikler
-
 Maskinlæring forbinder materialesammensætning og ydeevne i katalysatorerKredit:University of Michigan I et fund, der kunne være med til at bane vejen mod renere brændstoffer og en mere bæredygtig kemisk industri, forskere ved University of Michigan har brugt maskinlær
Maskinlæring forbinder materialesammensætning og ydeevne i katalysatorerKredit:University of Michigan I et fund, der kunne være med til at bane vejen mod renere brændstoffer og en mere bæredygtig kemisk industri, forskere ved University of Michigan har brugt maskinlær -
 Kemikere beviser mekanismen for direkte aminering fra benzenDet grafiske abstrakt af direkte aminering. Kredit:Tomsk Polytechnic University (TPU) Et team af kemikere fra Tomsk Polytekniske Universitet opdagede en mekanisme for direkte elektrofil aminering
Kemikere beviser mekanismen for direkte aminering fra benzenDet grafiske abstrakt af direkte aminering. Kredit:Tomsk Polytechnic University (TPU) Et team af kemikere fra Tomsk Polytekniske Universitet opdagede en mekanisme for direkte elektrofil aminering -
 Hvad er forskellen mellem relativ luftfugtighed og dugpunkt?Kredit:The American Chemical Society Meteorologer rapporterer ofte mængden af fugt i luften som relativ fugtighed eller dugpunkt. Disse foranstaltninger kan være forvirrende for folk, der bare
Hvad er forskellen mellem relativ luftfugtighed og dugpunkt?Kredit:The American Chemical Society Meteorologer rapporterer ofte mængden af fugt i luften som relativ fugtighed eller dugpunkt. Disse foranstaltninger kan være forvirrende for folk, der bare -
 Ny familie af selektive sølvbaserede kræftbekæmpende lægemidler opdagetEn familie af økonomiske sølvbaserede komplekser viser meget lovende resultater mod en række menneskelige kræftformer i laboratorietest, med meget lav toksicitet i rotteundersøgelser og minimale virkn
Ny familie af selektive sølvbaserede kræftbekæmpende lægemidler opdagetEn familie af økonomiske sølvbaserede komplekser viser meget lovende resultater mod en række menneskelige kræftformer i laboratorietest, med meget lav toksicitet i rotteundersøgelser og minimale virkn
- Biologisk Vs. Kemisk skadedyrsbekæmpelse
- Maksimal sikkerhed, da Filippinerne gør nedlukning af Boracay klar
- Carbon nanorør og uorganiske nanopartikler forbedrer fotosyntetisk aktivitet og stabilitet
- Hvad gør diatom i økosystemet?
- Ny forskning afslører, hvad der var på menuen for middelalderbønder
- Ren strøm er ikke nok


