Den hemmelige sulfatkode, der lader den dårlige Tau ind
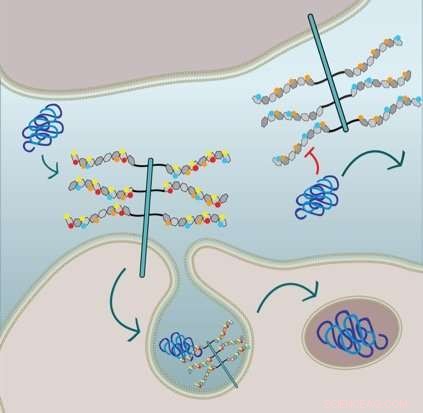
Figuren viser, at cellulær taufibriloptagelse kræver 6-O-sulfatering og N-sulfatering af HSPG-sidekæderne:Cellen i den nederste halvdel udtrykker HSPG'er med alle sulfatgrupperne og internaliserer tau via makropinocytose. Cellen i den øverste halvdel er genetisk modificeret og mangler N-sulfation (røde cirkler) og 6-O-sulfation (gule cirkler) og dermed, tau fibril optagelse hæmmes. Kredit:Sandi Jo Estill-Terpack, Barbara Stopschinsky
Vampyrer kan gøre mennesker til vampyrer, men for at komme ind i et menneskes hus, de skal inviteres ind. Forskere ved UT Southwestern Medical Center, skriver i Journal of Biological Chemistry , har afdækket detaljer om, hvordan celler inviterer inden i ødelagte proteiner, der kan gøre normale proteiner korrupte, fører til neurodegenerative sygdomme såsom Alzheimers og Parkinsons sygdomme. At forstå de molekylære detaljer om, hvordan disse proteiner spredes fra celle til celle, kan føre til terapier for at standse sygdomsprogression.
Alzheimers og Parkinsons er forbundet med bestemte proteiner i hjernen, der foldes forkert, aggregering, og få normale proteiner til at foldes sammen og aggregeres. Marc Diamonds gruppe ved UT Southwestern opdagede i 2013, at for at komme ind i nye celler og udbrede fejlfoldning, de sygdomsassocierede proteiner tau, alfa-synuclein og amyloid-beta skal binde sig til en type sukkerproteinmolekyle kaldet heparansulfatproteoglycan (HSPG) på cellens overflade. Denne binding udløser cellen til at bringe det beskadigede protein indeni. I den nye undersøgelse, gruppen søgte at forstå mere om, hvordan denne proces fungerede.
"Spørgsmålet var, hvor specifik er denne (proces)? Eller er det slet ikke specifikt? "Spurgte Barbara Stopschinski, lægen og forskeren i Diamond's lab, der havde tilsyn med det nye arbejde. Hvad var detaljerne i den kemiske kommunikation mellem HSPG og tau, der udløste taus indtræden i cellerne? Og var denne proces anderledes for alfa-synuclein (forbundet med Parkinsons sygdom), amyloid-beta og tau (begge forbundet med Alzheimers sygdom)?
HSPG'er kan have forskellige størrelser og strukturer; de kan dekoreres med forskellige sukkermønstre, og sukkerne kan selv indeholde forskellige mønstre af svovlholdige grupper (sulfatdele). Stopschinski testede systematisk, hvordan forskellige mønstre af sulfatgrupper påvirkede bindingen og optagelsen i celler af alfa-synuclein, amyloid-beta og tau.
Hun fandt ud af, at forkert foldet tau kun kunne komme ind i celler gennem et meget specifikt dekoreret og modificeret HSPG. Amyloid-beta og alfa-synuclein, på den anden side, var mere fleksible i den slags sulfatgrupper, der udløste deres optagelse. Desuden, Stopschinski identificerede enzymerne i cellerne, der skabte særlige sulfationsmønstre i HSPG'er. Da disse enzymer blev fjernet, fejlfoldet tau blev ikke længere optaget i celler, formodentlig fordi HSPG sukkerdekorationer og sulfationsmønstre ændrede sig, hvilket betyder fejlfoldet tau ikke længere kendte det molekylære kodeord.
Teamet ønsker nu at forstå, om disse processer fungerer på samme måde i hjernen, som de gør i kulturer af hjerneceller. Diamond håber, at forståelse af, hvordan ødelagte proteiner bevæger sig mellem hjerneceller, vil føre til måder at stoppe dem på.
"Der er noget meget bemærkelsesværdigt ved, hvor effektivt en celle vil optage disse aggregater, tag dem ind og brug dem til at lave mere, "Diamond sagde." Denne viden har vigtige konsekvenser for vores forståelse af, hvordan neurodegenerative sygdomme bliver værre med tiden. Fordi vi har identificeret specifikke enzymer, der kan hæmmes for at blokere denne proces, dette kan føre til nye terapier. "
Sidste artikelKontrol af fremstilling af stabile aerogeler
Næste artikelEn måde at lave renere metalfrie perovskitter til en lav pris
 Varme artikler
Varme artikler
-
 Identificeret:Molekylær struktur, der nedbryder en vigtig komponent i smogKredit:Pacific Northwest National Laboratory Kvælstofoxider, også kendt som NO x , dannes, når fossile brændstoffer brænder ved høje temperaturer. Når de udsendes fra industrielle kilder, såsom
Identificeret:Molekylær struktur, der nedbryder en vigtig komponent i smogKredit:Pacific Northwest National Laboratory Kvælstofoxider, også kendt som NO x , dannes, når fossile brændstoffer brænder ved høje temperaturer. Når de udsendes fra industrielle kilder, såsom -
 For at lave aminosyrer, tilføj bare elektricitetEn demonstrationsflowreaktor konstrueret af forskere ved Kyushu University omdanner løbende kildematerialer til aminosyrer gennem en reaktion drevet af elektricitet. Ved at vælge den rigtige kombinati
For at lave aminosyrer, tilføj bare elektricitetEn demonstrationsflowreaktor konstrueret af forskere ved Kyushu University omdanner løbende kildematerialer til aminosyrer gennem en reaktion drevet af elektricitet. Ved at vælge den rigtige kombinati -
 Forskere finder en ny måde at målrette mod influenzavirusRice University og Baylor College of Medicine forskere brugte computersimuleringer til at studere den proces, hvorved hæmagglutinin hjælper vira med at invadere og inficere celler. Forskerne mener, at
Forskere finder en ny måde at målrette mod influenzavirusRice University og Baylor College of Medicine forskere brugte computersimuleringer til at studere den proces, hvorved hæmagglutinin hjælper vira med at invadere og inficere celler. Forskerne mener, at -
 Team udvikler miljøvenligt, flammehæmmende kulstofplast ideel til genbrugKIST-forskergruppen brugte garvesyre fra plante til at udvikle en flammehæmmende kulfiberforstærket plast (CFRP) Kredit:Korea Institute of Science and Technology Der er udviklet et flammehæmmende
Team udvikler miljøvenligt, flammehæmmende kulstofplast ideel til genbrugKIST-forskergruppen brugte garvesyre fra plante til at udvikle en flammehæmmende kulfiberforstærket plast (CFRP) Kredit:Korea Institute of Science and Technology Der er udviklet et flammehæmmende
- Typer af regnmåler
- Hvorfor studerer forskere fossiler?
- Bæredygtige udviklingsmål, der kun kan opnås gennem tværfaglig forskning
- Undersøgelse tyder på, at Jorden og Månen ikke er identiske ilttvillinger
- Overraskende klitter på kometen Chury
- Efterskælv rammede jordskælvet på Kreta som græsk premierminister for at besøge


