Forskere ændrer membranproteiner for at gøre dem nemmere at studere
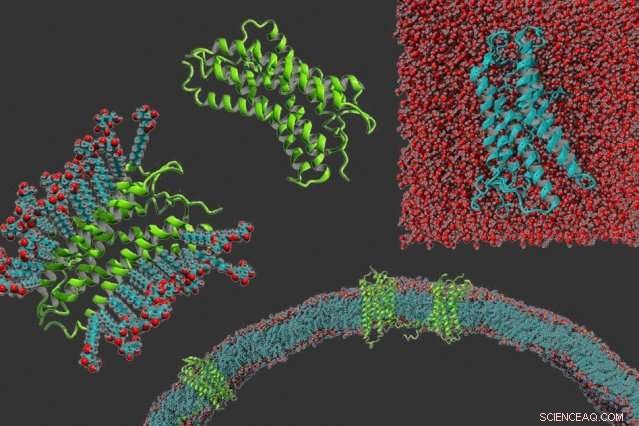
Med uret fra venstre:en g-proteinkoblet receptor i vaskemiddel, proteinet alene, en g-protein koblet receptor, der er blevet gjort vandopløselig, og g-proteinkoblede receptorer indlejret i en membran. Kredit:Michael Skuhersky
Omkring 30 procent af de proteiner, der kodes af det menneskelige genom, er membranproteiner - proteiner, der spænder over cellemembranen, så de kan lette kommunikationen mellem celler og deres miljø. Disse molekyler er afgørende for læring, ser, og mærker lugte, blandt mange andre funktioner.
På trods af udbredelsen af disse proteiner, videnskabsmænd har haft svært ved at studere deres strukturer og funktioner, fordi de membranbundne dele er meget hydrofobe, så de kan ikke opløses i vand. Det gør det meget sværere at lave strukturelle analyser, såsom røntgenkrystallografi.
I et fremskridt, der kunne gøre det lettere at udføre denne type strukturelle undersøgelser, MIT-forskere har udviklet en måde at gøre disse proteiner vandopløselige ved at bytte nogle af deres hydrofobe aminosyrer ud med hydrofile. Teknikken er baseret på en kode, der er meget enklere end tidligere udviklede metoder til at gøre disse proteiner opløselige, som er afhængige af computeralgoritmer, der skal tilpasses til hvert protein fra sag til sag.
"Hvis der ikke er nogen regel at følge, det er svært for folk at forstå, hvordan man gør det, " siger Shuguang Zhang, en hovedforsker i MIT Media Labs Center for Bits and Atoms. "Værktøjet skal være enkelt, noget som alle kan bruge, ikke en sofistikeret computersimulering, som kun få mennesker ved, hvordan man bruger."
Zhang er seniorforfatter af undersøgelsen, som fremgår af Proceedings of the National Academy of Sciences ugen den 27. august. Andre MIT-forfattere er tidligere gæsteprofessor Fei Tao, postdoc Rui Qing, tidligere gæsteprofessor Hongzhi Tang, kandidatstuderende Michael Skuhersky, tidligere bachelor Karolina Corin '03, SM '05, Ph.D. '11, tidligere postdoc Lotta Tegler, kandidatstuderende Asmamaw Wassie, og tidligere bachelor Brook Wassie '14.
En simpel kode
Af de cirka 8, 000 kendte membranproteiner fundet i humane celler, videnskabsmænd har opdaget strukturer i omkring 50. De betragtes bredt som meget vanskelige at arbejde med, fordi når de først er udvundet fra cellemembranen, de bevarer kun deres struktur, hvis de er suspenderet i et rengøringsmiddel, som efterligner det hydrofobe miljø i cellemembranen. Disse rengøringsmidler er dyre, og der er ikke noget universelt vaskemiddel, der virker til alle membranproteiner.
Zhang begyndte at arbejde på en ny måde at tackle dette problem på i 2010, inspireret af afdøde Alexander Rich, en MIT-professor i biologi. Rich stillede spørgsmålet om proteinstrukturer kaldet alfa-helixer, som udgør hovedparten af den membranindlejrede del af proteiner, kunne skiftes fra hydrofob til hydrofil. Zhang begyndte straks at finde mulige løsninger, men problemet viste sig at være svært. I løbet af de sidste otte år, han har haft flere studerende og gæsteforskere til at arbejde på hans idé, senest Qing, der opnåede succes.
Nøgleideen, der gjorde det muligt for Zhang at udvikle koden, er det faktum, at en håndfuld hydrofobe aminosyrer har meget lignende strukturer som nogle hydrofile aminosyrer. Disse ligheder gjorde det muligt for Zhang at komme med en kode, hvor leucin omdannes til glutamin, isoleucin og valin omdannes til threonin, og phenylalanin omdannes til tyrosin.
En anden vigtig faktor er, at ingen af disse aminosyrer er ladede, så at bytte dem ser ud til at have en minimal effekt på den overordnede proteinstruktur. Faktisk, isoleucin og threonin er så ens, at ribosomer, cellestrukturer, der samler proteiner, indsæt lejlighedsvis den forkerte - cirka én gang for hver 200 til 400 forekomster.

Postdoc Rui Qing og hovedforsker Shuguang Zhang ledede indsatsen for at finde en enkel måde at gøre membranbundne proteiner vandopløselige. Kredit:Jun Ni
Forskerne kalder deres kode for QTY-koden, efter de tre bogstaver, der repræsenterer glutamin, threonin, og tyrosin, henholdsvis.
I deres tidligste bestræbelser på at implementere denne kode, forskerne erstattede kun en lille del af de hydrofobe aminosyrer, der var indlejret i membranen, men de resulterende proteiner havde stadig brug for noget rengøringsmiddel til at blive opløst. De øgede udskiftningsraten til omkring 50 procent, men proteinerne var stadig ikke helt vandopløselige, så de erstattede alle forekomster af glutamin, isoleucin, valine, og phenylalanin indlejret i membranerne. Denne gang, de opnåede succes.
"Det er kun, når vi erstatter alle de hydrofobe rester i de transmembrane regioner, at vi er i stand til at få proteiner, der er stabile og fuldstændig fri for rengøringsmidler i et vandigt system, " siger Qing.
Strukturelle ligheder
I dette studie, forskerne demonstrerede deres teknik på fire proteiner, der tilhører en klasse af proteiner kendt som G-protein-koblede receptorer. Disse proteiner hjælper celler med at genkende molekyler, såsom hormoner, eller immunmolekyler, kaldet kemokiner, og udløse en passende reaktion i cellen.
Joel Sussman, en professor i strukturel biologi ved Weizmann Institute of Science, beskrev den nye metode som "utrolig enkel og elegant."
"Selvom en række videnskabsmænd har forsøgt at finde en måde at 'solubilisere' G-protein-koblede receptorer og andre integrerede membranproteiner, indtil nu har deres metoder ikke været til generel brug og ofte involveret meget komplekse beregningsmetoder, som ikke ville være bredt anvendelige, " siger Sussman, som ikke var involveret i undersøgelsen.
Forskerne arbejder stadig på at opnå de præcise strukturer af disse proteiner ved hjælp af røntgenkrystallografi eller nuklear magnetisk resonans (NMR), men de udførte nogle eksperimenter, der tyder på, at strukturerne ligner hinanden. I en, de viste, at de vandopløselige proteiner denaturerer ved næsten samme temperatur som de originale versioner af proteinerne. De viste også, at de modificerede proteiner binder til de samme målmolekyler, som de originale proteiner binder til, selvom det ikke er så stærkt.
At være i stand til at syntetisere vandopløselige versioner af disse proteiner kunne muliggøre nye applikationer, sensorer, der kan detektere miljøforurenende stoffer, siger forskerne.
En anden mulighed er at designe vandopløselige versioner af de proteiner, der binder til molekyler, der normalt udtrykkes af kræftceller, som kunne bruges til at diagnosticere tumorer eller identificere metastaserende kræftceller i blodprøver, siger Zhang. Forskere kunne også skabe vandopløselige molekyler, hvor en membranbundet receptor, som vira normalt binder til, er knyttet til en del af et antistof. Hvis disse "lokketerapier" blev sprøjtet ind i kroppen, vira vil binde sig til receptorerne og derefter blive renset af immunsystemet, som ville blive aktiveret af antistofdelen.
Sidste artikelForskere kaster nyt lys over molekylær adfærd
Næste artikelSkinnende røntgenlys på perovskiter for bedre solceller
 Varme artikler
Varme artikler
-
 Nanosensorer forbedrer påvisning af sygdomsbiomarkører i udåndet åndeKAIST-forskere designede nanofibre (grå) med proteinindkapslede katalysatorer (orange) for at øge følsomheden og selektiviteten af åndedrætssensorer til sygdomsdetektion. Kredit:KAIST Forskere f
Nanosensorer forbedrer påvisning af sygdomsbiomarkører i udåndet åndeKAIST-forskere designede nanofibre (grå) med proteinindkapslede katalysatorer (orange) for at øge følsomheden og selektiviteten af åndedrætssensorer til sygdomsdetektion. Kredit:KAIST Forskere f -
 Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg
Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg -
 Biologisk fyrværkeri viser 300 millioner år undervejsFrøæg som dem, der er afbildet her, frigiver zink, når de befrugtes, ligesom pattedyræg gør. Kredit:Tero Laakso/licenseret under CC BY-SA 2.0. Fem år siden, forskere ved Northwestern University la
Biologisk fyrværkeri viser 300 millioner år undervejsFrøæg som dem, der er afbildet her, frigiver zink, når de befrugtes, ligesom pattedyræg gør. Kredit:Tero Laakso/licenseret under CC BY-SA 2.0. Fem år siden, forskere ved Northwestern University la -
 Fremstilling af biodiesel med grønne opløsningsmidlerKredit:Pixabay/CC0 Public Domain Grønne opløsningsmidler til fremstilling af biodiesel vil reducere miljøpåvirkningen af sådanne brændstoffer yderligere. Skrivning i World Review of Science, Te
Fremstilling af biodiesel med grønne opløsningsmidlerKredit:Pixabay/CC0 Public Domain Grønne opløsningsmidler til fremstilling af biodiesel vil reducere miljøpåvirkningen af sådanne brændstoffer yderligere. Skrivning i World Review of Science, Te


