Ny metode til hydroborering af alkyner:Radikaler inducerer usædvanlig selektivitet
Oversigt over den nuværende forskning Kredit:Kanazawa University
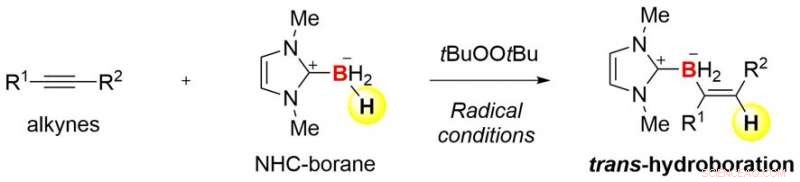
En kombination af organobor og radikal kemi genererer usædvanlig trans-selektivitet i hydroborering af alkyner. Brugen af N-heterocykliske carbenboraner er nøglen til succesen med denne kemiske transformation. Denne undersøgelse forventes at åbne døren til udviklingen af nye borholdige materialer.
Organoborforbindelser er blevet brugt i vid udstrækning til at skabe nye organiske molekyler siden Prof. Suzuki, en nobelprisvinder i kemi i 2010, udviklet palladium-katalyserede krydskoblingsreaktioner med organoborforbindelser (Suzuki-kobling). Ud over, mange borholdige forbindelser er i sig selv lovende materialer. De kan bruges som medicin og organiske elektroluminescensmaterialer på grund af bors unikke elektroniske natur.
Boran (BH3) og dets derivater stabiliseret af ligander er de enkleste borforbindelser. De kan reagere med en kulstof-kulstof tripelbinding (alkyn, C-C) for at give et insertionsprodukt (H-C=C-BH 2 ). denne reaktion, kaldet hydroboration, er en kraftfuld metode til at fremstille organoborforbindelser. Imidlertid, reaktionen giver typisk kun et cis-produkt, hvilket betyder, at H og BH 2 indføres på samme side af tripelbindingen. Det er, det er vanskeligt at syntetisere et trans-hydroboreringsprodukt med den modsatte geometriske konfiguration. Tidligere, der har været meget begrænsede eksempler på trans-hydroborering af alkyner.
Oversigt over reaktionsmekanismen. Kredit:Kanazawa University
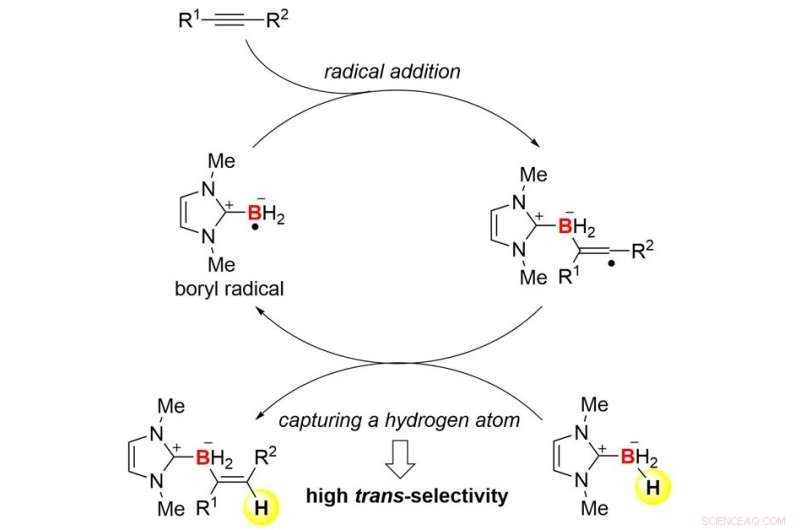
Samarbejdsteamet mellem Kanazawa University og University of Pittsburgh lykkedes med udviklingen af trans-hydroboreringsreaktioner af alkyner baseret på radikal kemi (figur 1). Holdet brugte N-heterocykliske carbenboraner (NHC-boraner) til at kombinere hydroborering med radikal kemi. NHC-boraner kan nemt håndteres på grund af deres stabilitet, og de er gode forløbere for borylradikaler (borcentrerede radikaler). Ja, et NHC-borylradikal kan let dannes ved simpel termolyse i nærværelse af billigt kommercielt di-tert-butylperoxid. Radikalet kan tilføjes til en alkyn for at danne en carbon-bor (C-B)-binding og et nyt carbon-radikal (figur 2). Trans-selektivitet ved hydroborering induceres kinetisk, når det meget reaktive kulstofradikal fanger et hydrogenatom fra start-NHC-boranen. Som resultat, den overordnede proces etablerer en radikal kædecyklus. Denne mekanisme er ret forskellig fra den for kendte hydroboreringsreaktioner.
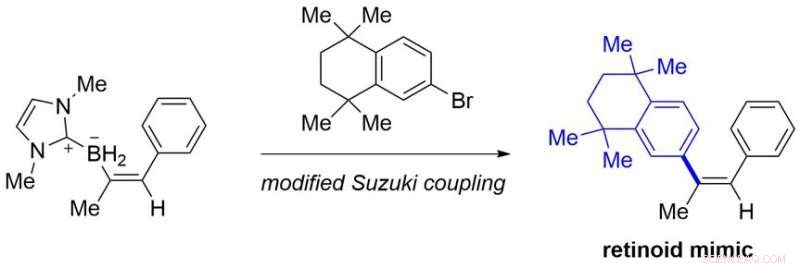
Fra let tilgængelige alkyner, den foreliggende protokol tilvejebringer forskellige bench-stabile alkenylboranforbindelser, som ikke er let tilgængelige ved kendte metoder. Nogle af dem kan omdannes til retinoid mimik, som er lægemiddelkandidater, ved modificeret Suzuki-kobling (Figur 3).
Anvendelsen af et syntetiseret produkt. Kredit:Kanazawa University
Organoborforbindelser syntetiseret ved den foreliggende metode vil give adgang til nye borholdige π-systemer ved yderligere kemisk transformation. Derfor, denne type trans-hydroboreringsreaktion vil lette fremskridt inden for medicinsk kemi og materialevidenskab. Fra et synspunkt om ren kemi, denne undersøgelse udvider potentialet for radikaler i syntetisk kemi. Kort sagt, vi illustrerer, at radikaler er i stand til at kontrollere kemiske reaktioner præcist på trods af deres ekstreme reaktivitet.
Dennis Curran (University of Pittsburgh), en samarbejdspartner i denne undersøgelse, siger, "Det har været en fornøjelse at være involveret i dette samarbejde, som blev ledet af Kanazawa-holdet. Den nye reaktion, som vi har opdaget, er unik, og jeg er spændt på dets udsigter til udvidelse i retning af både grundforskning og praktiske anvendelser."
 Varme artikler
Varme artikler
-
 Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknikFotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen b
Forskere bruger molekylære tether og kemiske lyssabler til at konstruere platforme til vævsteknikFotofrigivelse af proteiner fra epidermal vækstfaktor (EGF) på den ene side af en human celle. Til venstre:EGF (grøn) er bundet til en hydrogel en enkelt menneskelig celle (i midten). Cellemembranen b -
 Forskere opdager en hurtigere måde at fremstille vaskulære materialer påSynkroniseret fremstilling af en bioinspireret struktur med et hierarkisk vaskulært netværk. Kredit:Mayank Garg, Nancy Sottos, Jeff Moore, og Phillipe Guebelle At udvikle selvhelbredende materiale
Forskere opdager en hurtigere måde at fremstille vaskulære materialer påSynkroniseret fremstilling af en bioinspireret struktur med et hierarkisk vaskulært netværk. Kredit:Mayank Garg, Nancy Sottos, Jeff Moore, og Phillipe Guebelle At udvikle selvhelbredende materiale -
 Forskere er pionerer på en grønnere måde at skabe sammenvævede polymerer med blåt lysUniversity of Delaware forskere lavede universitetets logo ved hjælp af deres nyudviklede polymerisationsteknik. Kredit:Abhishek Shete/ University of Delaware Et par ingeniører ved University of D
Forskere er pionerer på en grønnere måde at skabe sammenvævede polymerer med blåt lysUniversity of Delaware forskere lavede universitetets logo ved hjælp af deres nyudviklede polymerisationsteknik. Kredit:Abhishek Shete/ University of Delaware Et par ingeniører ved University of D -
 Biokemikere afslører indsigt i ekstraordinær regenerativ evneIana Kim, første forfatter til den nye undersøgelse, i et laboratorium for forskningsgruppen Gene Regulation by Non-coding RNA ved University of Bayreuth. Kredit:Christian Wißler Planarer er flado
Biokemikere afslører indsigt i ekstraordinær regenerativ evneIana Kim, første forfatter til den nye undersøgelse, i et laboratorium for forskningsgruppen Gene Regulation by Non-coding RNA ved University of Bayreuth. Kredit:Christian Wißler Planarer er flado
- Jorden kunne have understøttet skorpen, livet tidligere end antaget
- Kontrol af knæk i en nanoskala ved hjælp af elektrostatiske effekter
- Fremskyndelse af klinisk brug af Raman-spektroskopi-kemiske fingeraftryk
- Undersøgelse af grafenkatalysatorer finder metal i metalfrie katalysatorer
- Programmerbare optiske fibre med flere kerner indstillet til at holde film og musik streaming ind i …
- Forskellen mellem Polyethylen & PVC


