Gnisten der skabte liv
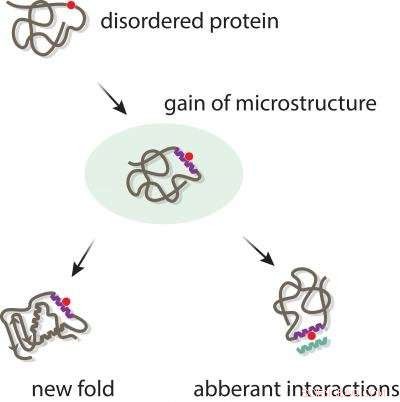
Evolution ved naturlig udvælgelse er uhyre stærk - både i naturen og i laboratorier. Forskere har identificeret 'strukturelle kapacitanselementer' i proteiner, som bevarer potentialet til at udvikle sig til mikrostrukturer efter introduktionen af en mutation. Disse muterede proteiner er forbundet med mange forskellige typer af menneskelige sygdomme, såsom kræft. At forstå, om og hvordan en mutation kan ændre proteinformen, vil være afgørende for at målrette det protein til brug i terapeutiske midler. Kredit:Monash University
Evolution ved darwinistisk naturlig udvælgelse er uhyre stærk – både i naturen og i laboratorier. Ved at bruge 'laboratorie-evolution', vi kan tage et enzym, der kombinerer tilfældige mutationer og funktionel selektion, og forbedre dens funktion med mere end 1000 gange. Du kan se beviser på, at videnskaben udnytter evolutionen på tværs af feltet, fra syntetiserede lægemidler, der bruges til at forhindre gentagelse af hjerteanfald (betablokkere) til udvikling af tumor-målrettet antistofterapi.
Imidlertid, intet udvikler sig, medmindre det allerede eksisterer. Da livet startede for mere end tre milliarder år siden, hvad var gnisten, der skabte noget fra tilfældighed?
Forskere fra Monash Biomedicine Discovery Institute (BDI), har identificeret, hvad de har kaldt 'strukturelle kapacitanselementer' i muterede proteiner, der er forbundet med mange forskellige typer af menneskelige sygdomme, især en række kræftformer.
Strukturelle kapacitanselementer er lokaliserede områder med uorden i proteiner, som bevarer potentialet til at smelte sammen til "mikrostrukturer" efter introduktionen af en mutation. De fungerer som kernedannende frø, eller 'råvare' for at evolutionen kan fortsætte, danner grundlag for en accelereret mekanisme for darwinistisk evolution ved naturlig selektion, som supplement til den langsomme og gradvise proces af klassisk darwinistisk evolution.
Denne opdagelse er for nylig blevet offentliggjort i Journal of Molecular Biology . Ledende forsker på dette papir, Lektor Ashley Buckle, forklarede betydningen af denne opdagelse.
"Indtil nu, den fremherskende overbevisning blandt strukturbiologer har været, at mutationer, der er impliceret i sygdom, virker ved at forstyrre proteinstrukturer - typisk omtalt som 'tab-af-struktur-funktion'-paradigmet. Men det er for nylig blevet afsløret, at mere end 40 procent af proteinerne overhovedet ikke har nogen veldefineret struktur, " sagde lektor Buckle.
"Dette fik os til at stille et helt andet spørgsmål, og vende den fremherskende tro på hovedet, " han sagde.
Forskerholdet analyserede mange af disse sygdomsassocierede mutationer og fandt ud af, at disse 'Strukturelle Kapacitanselementer' kan tillade mutationer at udløse en 'gain-of-function' ved at inducere struktur, hvor ingen eksisterede før.
"Vi indså, at vores arbejde kan have forskellige implikationer. Ikke kun kaster det lys over udviklingen af proteinstrukturer, det kan give indsigt i konstruktionen af meget evolverbare proteiner, og identifikation og selektiv målretning af humane sygdomsepitoper, " han sagde.
"At forstå, om og hvordan en mutation kan ændre proteinformen, vil være afgørende for at målrette dette protein til brug i terapier, der genkender den muterede region."
 Varme artikler
Varme artikler
-
 Et skridt hen imod syntese af metalorganiske strukturerKredit:Catalan Institute of Nanoscience and Nanotechnology Dr. Inhar Imaz og ICREA-professor Daniel Maspoch er hjernen bag en ny metode til organisk metalstruktursyntese. Deres spraytørringsteknik
Et skridt hen imod syntese af metalorganiske strukturerKredit:Catalan Institute of Nanoscience and Nanotechnology Dr. Inhar Imaz og ICREA-professor Daniel Maspoch er hjernen bag en ny metode til organisk metalstruktursyntese. Deres spraytørringsteknik -
 Forskere designer dendritfrit lithiumbatteriEn tynd asymmetrisk fast elektrolyt opfylder både kravene til litiummetal (blokering af dendritdannelse) og katode (muliggør lav grænseflademodstand). Kredit:H. Duan et al. ©2017 American Chemical Soc
Forskere designer dendritfrit lithiumbatteriEn tynd asymmetrisk fast elektrolyt opfylder både kravene til litiummetal (blokering af dendritdannelse) og katode (muliggør lav grænseflademodstand). Kredit:H. Duan et al. ©2017 American Chemical Soc -
 Formiat dehydrogenase reducerer kuldioxid til myresyreKredit:Osaka City University Professor Yutaka Amao fra Osaka City University Artificial Photosynthesis Research Center og Ryohei Sato, en 1. års ph.d. studerende ved Graduate School of Science med
Formiat dehydrogenase reducerer kuldioxid til myresyreKredit:Osaka City University Professor Yutaka Amao fra Osaka City University Artificial Photosynthesis Research Center og Ryohei Sato, en 1. års ph.d. studerende ved Graduate School of Science med -
 Vidensgab lukket i vores forståelse af nedbrydning af ethanDannelse af små vesikler indikerer, at Candidatus Argoarchaeum ethanivorans deler sig ved knopskydning. Forskerne opdagede disse strukturer med et højopløseligt helium-ionmikroskop. De arkæiske celler
Vidensgab lukket i vores forståelse af nedbrydning af ethanDannelse af små vesikler indikerer, at Candidatus Argoarchaeum ethanivorans deler sig ved knopskydning. Forskerne opdagede disse strukturer med et højopløseligt helium-ionmikroskop. De arkæiske celler


