Cellulære oprydningsteams knyttet til, hvordan kroppen håndterer sukker

Asst. Prof. Raymond Moellering (til højre) med kandidatstuderende John Coukos (til venstre) og Gihoon Lee (i midten). Kredit:Irene Hsiao
Hvordan vores kroppe håndterer glukose - det simple sukker, der giver energi fra den mad, vi spiser - ser ud til at være sammenflettet med, hvordan celler holder sig til at fungere normalt, ifølge ny forskning fra University of Chicago.
Studiet, offentliggjort med Scripps Research Institute-forskere den 15. oktober i Natur , fundet en sammenhæng mellem den proces, der håndterer glukose i celler, og den, der regulerer afgiftning. Dette antyder en ny forståelse af en grundlæggende funktion i vores kroppe, og en, der kan give ny indsigt i lidelser fra kræft til diabetes.
Raymond Mølling, adjunkt ved Institut for Kemi ved UChicago, forsøgte at pirre rollen af et bestemt molekyle involveret i den vej, der udløser en celles afgiftningsproces - en slags rengøringspersonale til at fjerne toksiner og ophobninger, når noget går galt i cellen. Denne vej dukker op, når du studerer alle mulige lidelser:kræft, diabetes, inflammatoriske sygdomme og neurodegenerative lidelser som Alzheimers sygdom.
Det så ud til, at nøgleproteinet til at udløse denne vej, KEAP1, blev aktiveret af et nyt lille molekyle opdaget i laboratoriet - men det så ikke ud til at bruge nogen af de normale mekanismer, som forskerne kender.
Ved at spore de veje, der påvirkes af dette molekyle, Moellerings team fandt ud af, at det involverede en anden vej udover afgiftning:den vej, som kroppen bruger til at behandle glukose. "Ingen vidste, at de var direkte forbundet, " sagde Moellering.
Hvordan vores kroppe håndterer glukose, som produceres, når vi nedbryder mad til energi, er afgørende for stort set alt liv rundt om på kloden - og derfor vigtig i mange sygdomme, såsom diabetes. Fordi det er så gammelt og grundlæggende, det er også en virkelig svær vej at manipulere i laboratoriet. "I modsætning til mange gener eller veje i menneskelige celler, du kan ikke bare lukke for processer involveret i glukosemetabolisme for at se, hvordan det forbinder med andre veje, fordi hvis du gør, dør cellen, og forbindelserne går tabt, " sagde Moellering.
Heldigvis, svære biologiske problemer er Moellerings speciale. I de fleste af teknikkerne til at studere biologi, videnskabsmænd kan kun skimte snapshots af celleaktivitet - som at prøve at forstå plottet af The Matrix baseret på et par billeder ud af hele filmen. Moellerings laboratorium forsøger at afhjælpe det ved at udvikle teknologi til at måle aktivitet og interaktioner i levende celler, mens det sker.
Ved at bruge en kombination af teknikker, de fandt ud af, at KEAP1 faktisk udløses til handling af en ophobning af glukose i cellen. "Det ser meget tydeligt ud som om KEAP1 lytter til glukosemetabolisme, og tænde detox-mekanismer som et resultat, " sagde Moellering.
Den mærkelige del var, hvordan dette sker. Forskere viste, at når KEAP1 udsættes for et molekyle, der produceres under nedbrydningen af glukose, individuelle KEAP1-proteiner går sammen i par, som så udløser et vandfald af andre signaler i cellen til at begynde afgiftningsmekanismer. Tidligere metoder kunne ikke opdage, hvordan disse molekyler, proteiner og veje interagerer i cellen.
Åbner nye veje
Opdagelsen er spændende på flere niveauer, sagde Møllering. Denne særlige vej er et fingerpeg om at forstå alle former for lidelser, fordi afgiftning er så vigtig en rolle i cellen. Der er også meget, forskerne ikke ved om glukose, hvordan præcis ændringer i glukosemetabolismen bidrager til komplikationer i sygdomme, såsom nerveskader, der ledsager diabetes.
Derudover arbejdet viser, at cellen beskytter sig selv mod skader ved at udløse afgiftning via glukosemetabolisme, men at skubbe dette signal for langt - som det kan ske ved sygdomme som diabetes - kan føre til skader, der overstiger oprydningspersonalets kapacitet. "For mange sygdomme, der involverer glukosemetabolisme, det er spændende nu at spørge, om denne vej er involveret, " sagde Moellering.
På et andet niveau, denne opdagelse ser ud til at etablere en ny kategori af, hvordan proteiner kontrolleres i kroppen. I deres søgen efter at forstå, hvad der sker hver dag i menneskelige celler, videnskabsmænd kender to vigtige måder, hvorpå proteiner kan gøre deres forretninger. En måde er for enzymer at sætte kemiske mærker på proteiner, slukke og tænde dem. Den anden måde er, at fritsvævende molekyler i cellen reversibelt interagerer med proteiner for at kontrollere deres funktioner. Denne undersøgelse ser ud til at etablere en tredje måde, som er en hybrid af de to - hvor disse fritsvævende molekyler direkte danner kemiske mærker på de proteiner, de interagerer med, forårsager specifikke og længerevarende virkninger. "At finde denne form for regulering med KEAP1 tyder på, at det er en udbredt måde at kontrollere proteinfunktionen på, " sagde Moellering.
Opdagelsen antyder nye terapeutiske muligheder. Farmaceutiske virksomheder er meget interesserede i, hvordan man aktiverer og deaktiverer KEAP1, fordi det er nøglen til så mange lidelser. Tidligere forsøg med fokus på at målrette KEAP1 selv er stødt på udfordringer i kliniske forsøg; denne nye forståelse af, hvordan metabolisme integreres i banen, kan foreslå en ny mekanisme til at opnå den samme effekt, sagde Møllering.
 Varme artikler
Varme artikler
-
 AdskillelseslinjeKredit:Erin Dauson, Institut for Civil- og Miljøteknik, Carnegie Mellon University For patienter med behov for blod, det er fatalt vigtigt, at de modtager den rigtige type. Derfor vil læger ofte g
AdskillelseslinjeKredit:Erin Dauson, Institut for Civil- og Miljøteknik, Carnegie Mellon University For patienter med behov for blod, det er fatalt vigtigt, at de modtager den rigtige type. Derfor vil læger ofte g -
 Det tosprogede molekyle forbinder to grundlæggende koder for livetDet nye molekyle rummer potentialet for forskellige biomedicinske anvendelser, siger Emory -kemiker Jennifer Heemstra (til højre), seniorforfatter af papiret. Hun vises i sit laboratorium med kandidat
Det tosprogede molekyle forbinder to grundlæggende koder for livetDet nye molekyle rummer potentialet for forskellige biomedicinske anvendelser, siger Emory -kemiker Jennifer Heemstra (til højre), seniorforfatter af papiret. Hun vises i sit laboratorium med kandidat -
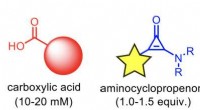 Lysinduceret modifikation af en carboxylsyre med en aminocyclopropenonFotoudløst modifikation af en carboxylsyre ved hjælp af en aminocyclopropenon. Reaktionen afsluttes på kort tid (5-10 min) selv ved lav koncentration (10-20 mM). Modifikationsreaktionen forløber i op
Lysinduceret modifikation af en carboxylsyre med en aminocyclopropenonFotoudløst modifikation af en carboxylsyre ved hjælp af en aminocyclopropenon. Reaktionen afsluttes på kort tid (5-10 min) selv ved lav koncentration (10-20 mM). Modifikationsreaktionen forløber i op -
 Brug af guldpartikler til at gøre det usynlige synligtKredit:Leiden Universitet Guld nanopartikler giver os en bedre forståelse af enzymer og andre molekyler. Biswajit Pradhan, Ph.d. kandidat ved Leiden Institute of Physics, bruger guld nanorods til
Brug af guldpartikler til at gøre det usynlige synligtKredit:Leiden Universitet Guld nanopartikler giver os en bedre forståelse af enzymer og andre molekyler. Biswajit Pradhan, Ph.d. kandidat ved Leiden Institute of Physics, bruger guld nanorods til
- Efterhånden som angrebsdroner formerer sig, Israelske firmaer udvikler forsvar
- Canada fejler i kampen mod klimaændringer:vagthund
- 5 evidensbaserede måder, lærere kan hjælpe svære elever på
- Nye briller til at uddybe visningen af NASAs romerske rumteleskop
- Selvhelbredende materiale et gennembrud for bio-inspireret robotteknologi
- Blå himmel i Kinas hovedstad vækker glæde, skepsis


