Forskere løser 3D-struktur af cystisk fibrose-protein i aktive, inaktive stater
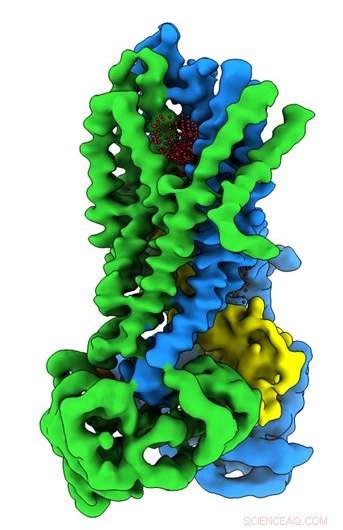
Kredit:University of North Carolina ved Chapel Hill School of Medicine
Forskere ved UNC School of Medicine i samarbejde med forskere ved Oregon Health &Science University har løst den tredimensionelle molekylære struktur af proteinet, der er defekt hos mennesker med cystisk fibrose i proteinets aktive og inaktive tilstand. Opdagelsen, offentliggjort i tidsskriftet Biokemi , kunne åbne nye forskningsveje og hjælpe lægemiddeludviklere med at skabe forbedrede farmakoterapier for at hjælpe mennesker med CF.
Meget af biokemiarbejdet blev udført i laboratoriet af John Riordan, Ph.d., fremtrædende professor i biokemi og biofysik ved UNC-Chapel Hill. I slutningen af 1980'erne, Riordans laboratorium opdagede det muterede gen, der var ansvarlig for CF. Hvis et barn modtager en kopi af dette defekte gen fra hver forælder, barnet vil udvikle CF. Proteinet kodet af dette gen blev betegnet som cystisk fibrose transmembranregulator, eller CFTR, som er kloridkanalen i epitelceller, der befolker luftvejene. Personer med CF mangler en funktionel epitelchloridkanal, hvilket er afgørende for at opretholde den korrekte balance mellem salt og vand i lunger og andre organer. Et resultat af dette er produktionen af tykke, klistret slim, der bliver svært at bevæge sig ud af luftvejene, fører til kroniske infektioner og en kortere levetid for de fleste mennesker med CF.
I Riordan -laboratoriet, postdoktor Jonathan Fay, Ph.d., ledede eksperimenter ved hjælp af enkeltpartikel kryo-elektronmikroskopi for at opdage molekylstrukturen af CFTR i nærvær af ATP-et komplekst organisk kemikalie, der er nødvendigt for mange processer i celler, herunder en fungerende chloridionkanal afgørende for korrekt lungefunktion. For at hjælpe med at fange strukturer af CFTR -proteinet i dets aktive og inaktive tilstand, Riordan-laboratoriet stabiliserede CFTR-proteinet, således at kanalen var slukket, når dephosphoryleret og låst på, når den blev phosphoryleret.
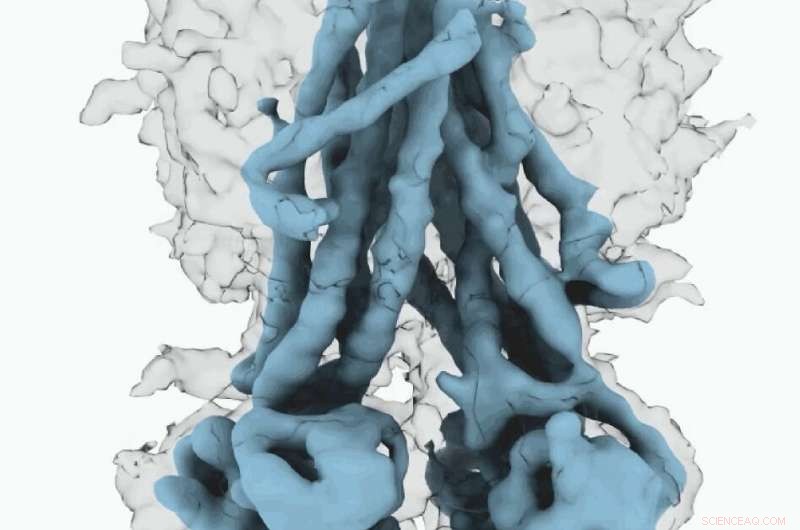
Cryo-EM kort over CFTR. Kredit:University of North Carolina ved Chapel Hill School of Medicine
Disse molekylære strukturer afslører en unik repositionering af dele af CFTR -proteinet, giver indsigt i den strukturelle overgang mellem aktive og inaktive funktionelle tilstande for CFTR.
I øvrigt, Fay og kolleger observerede detaljer om dette proteinkompleks, der adskiller sig fra, hvad andre forskere har opdaget i tidligere CFTR -strukturer.
"Det er virkelig forbløffende, hvor meget cryo-EM-teknologier har avanceret, og hvordan brugen af disse teknikker kan give os mulighed for at visualisere forskellige tilstande i kanalen, "Fay sagde." Jeg synes, vores resultater er meget spændende. Vi opdagede en ny portal, der præsenterer et lovende nyt område af kanalen til målretning og kontrol af CFTR -kanalfunktion. "
Og hvis forskere med succes kan målrette og kontrollere funktionen af den kanal, så kunne de oprette mere præcise terapier til bedre at behandle nogle mennesker med CF.
 Varme artikler
Varme artikler
-
 Forskere udvikler nemmere og hurtigere måde at kvantificere, udforske terapeutiske proteinerKredit:CC0 Public Domain Forskere ved New Jersey Institute of Technology i samarbejde med Ohio University og Merck &Co. Inc. har for nylig udviklet en ny effektiv metode til målrettet proteinanaly
Forskere udvikler nemmere og hurtigere måde at kvantificere, udforske terapeutiske proteinerKredit:CC0 Public Domain Forskere ved New Jersey Institute of Technology i samarbejde med Ohio University og Merck &Co. Inc. har for nylig udviklet en ny effektiv metode til målrettet proteinanaly -
 Næste generations 3D-trykte katalysatorer til at drive hypersonisk flyvningUdviklet som en del af NASAs Hyper-X-program, X-43A hypersonisk forskningskøretøj lavede luftfartshistorie i 2004, når hastigheder over Mach 9,6 eller over 10, 000 km/t. Kredit:NASA Ultraeffektive
Næste generations 3D-trykte katalysatorer til at drive hypersonisk flyvningUdviklet som en del af NASAs Hyper-X-program, X-43A hypersonisk forskningskøretøj lavede luftfartshistorie i 2004, når hastigheder over Mach 9,6 eller over 10, 000 km/t. Kredit:NASA Ultraeffektive -
 De fem mest mærkelige giftstoffer, der kan dræbe digDer er nogle skøre giftstoffer i vores verden, og de findes ofte i ting, du mindst ville forvente. I denne uges afsnit af Reaktioner, vi nedbryder vores top fem mærkeligste giftstoffer.
De fem mest mærkelige giftstoffer, der kan dræbe digDer er nogle skøre giftstoffer i vores verden, og de findes ofte i ting, du mindst ville forvente. I denne uges afsnit af Reaktioner, vi nedbryder vores top fem mærkeligste giftstoffer. -
 Kan jeg blande disse kemikalier? Der er en app til det!En visuel fremstilling, der viser, hvordan tildeling af graffarveregistre fungerer. Kredit:Jason Ott/UCR Forkert blandede kemikalier forårsager et chokerende antal brande, eksplosioner, og skader
Kan jeg blande disse kemikalier? Der er en app til det!En visuel fremstilling, der viser, hvordan tildeling af graffarveregistre fungerer. Kredit:Jason Ott/UCR Forkert blandede kemikalier forårsager et chokerende antal brande, eksplosioner, og skader
- NY opstart sigter mod at indtage Teslas Powerwall
- Satellitbilleder afslører, hvor store mængder metan frigives i Permian Basin
- Udvikling af en gravitationsteori for økologi
- Gør dig klar til sommersolen med grønne solcremer
- Metal Organic Framework (MOF) mikrokrystaller til flerfarvet bredbåndslasing
- Teenagere undgår lektier til sociale medier og videospil


