De 10 fod høje mikroskoper hjælper med at bekæmpe verdens værste sygdomme
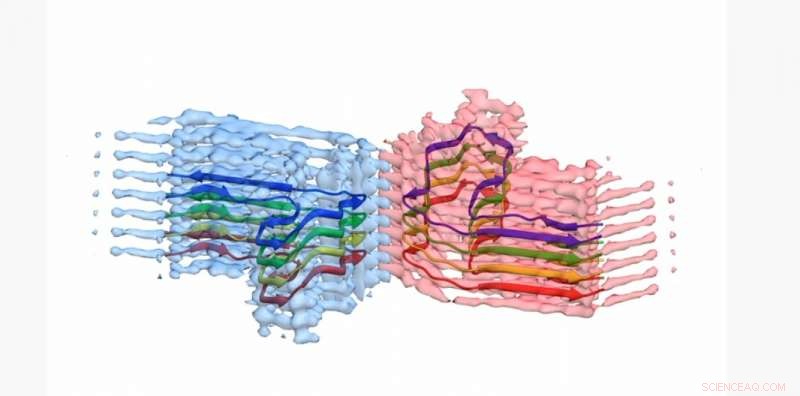
Et snit af en b2m amyloid fibril, med atommodellen for 8 kopier af b2m-proteinet indbygget i EM-densiteten. Fibrillen er bygget op af to 'protofilamenter', der vikler sig om hinanden (blå og pink). Denne sektion er omkring 4 milliardtedele af en meter lang Credit:University of Leeds
Den århundrede gamle mission for at forstå, hvordan proteinerne er ansvarlige for amyloid-baserede sygdomme som Alzheimers, Huntingdons og Parkinsons arbejde har taget store skridt fremad i de sidste 12 måneder, takket være en revolution inden for en kraftfuld mikroskopiteknik brugt af videnskabsmænd.
Kraftige mikroskoper, der bruger elektroner i stedet for lys til at 'se' den faktiske form af prøver sat under dem, på næsten atomare detaljeringsniveauer, er først for nylig blevet tilgængelige for britiske videnskabsmænd.
Det Forenede Kongerige har investeret massivt i de 'spilskiftende' kryo-elektronmikroskoper, men der er stadig færre end 25 af instrumenterne på flere millioner pund på britiske universiteter og forskningsinstitutter.
De to instrumenter ved University of Leeds, finansieret af universitetet selv og Wellcome, er de eneste af deres slags i det nordlige England.
De har allerede bevist deres værd som et nøgleværktøj for forskere, der har brugt dem i en række forskningsprojekter, men har netop leveret deres største succes endnu:at afsløre strukturen af amyloid - en opbygning af unormale proteiner i kroppen, der forårsager sygdom.
Der er mindre end 10 billeder af god kvalitet og strukturer af denne slags proteiner tilgængelige for undersøgelse i verden, så Leeds' forskning yder et væsentligt bidrag til videnskabsmænds forståelse af, hvordan proteiner danner aggregater, og hvordan de kan bidrage til amyloidsygdom.
Billederne og 3D-strukturerne af proteinaggregaterne - som Leeds-forskerne viste dannede lange, snoede fibre - er blevet offentliggjort i tidsskriftet Naturkommunikation . Det involverede protein - β2-mikroglobulin - er normalt involveret i et sundt immunsystem, men kan samle sig til de smertefremkaldende amyloidfibre hos mennesker, der gennemgår langvarig dialyse for nyresvigt. Når de sætter sig fast i folks led, kan de forårsage slidgigt
Det forventes, at resultaterne vil blive brugt af lægemiddelproducenter og forskningsgrupper internationalt, som stræber efter at finansiere kure mod amyloidsygdomme af alle typer.
Professor Sheena Radford FMedSci, FRS og professor Neil Ranson fra universitetets Astbury Center for Structural Molecular Biology, førte det femårige program til at afbilde proteinfibrene og vise deres 3D-struktur.
Parret blev støttet af kolleger hos Leeds, Josh Boardman, som på det tidspunkt var bachelorstuderende i biokemi.

Dr. Rebecca Thompson, University of Leeds' Cryo-Electron Microscopy Center Manager indlæser en prøve i et af mikroskoperne. Kredit:University of Leeds
Undersøgelsen involverede også et mangeårigt samarbejde med professor Bob Griffin, fra Massachusetts Institute for Technology, som har specialiseret sig i en anden metode til avanceret biologisk analyse af biologisk stof - faststof-kernemagnetisk resonans.
Professor Radford sagde:"I løbet af de sidste seks årtier siden de første elektronmikroskopibilleder af amyloid blev skabt, forskere er gået fra at arbejde med slørede billeder i lav opløsning til vores knivskarpe 3-D billeder og strukturer, takket være moderne fremskridt inden for kryo-elektronmikroskopi.
"Nu ved vi præcis, hvor hvert knæk og punkt er på proteinet, vi kan muligvis udvikle forbindelser, der låser sig tæt til det, eller forstyrre det, og find ud af, hvordan fibrene bidrager til sygdom. Det svarer til at gå fra at prøve at få to balloner til at hænge sammen til at have to tandhjul, der roterer perfekt med hinanden.
Hun tilføjede:"Vi har brugt kryo-elektronmikroskopi ikke kun til at afdække formen og strukturen af amyloidproteiner, men også hvordan de vokser og fletter sig ind i hinanden som standene i et reb for at danne større samlinger. Denne viden bliver afgørende for at vide, hvordan man håndterer dem."
Professor Ranson sagde:"Indtil for et år eller deromkring siden, videnskabsmænd vidste, at strukturen lignede mere eller mindre en stige, men vi har nu vist, at det er meget mere komplekst end som så. Vi er nu begyndt at se, hvordan forskellige proteiner foldes sammen i forskellige former, og hvordan de varierer med hver sygdom, de forårsager.
"Den ekstra detalje, vi har afdækket, betyder, at vi kan begynde at forstå disse proteiners sygdomsfremkaldende evner.
Han tilføjede "Amyloidfibre er også kendt for at have stålstyrken, og, nu forstår vi deres strukturer. Vi kan måske lave nye biomaterialer inspireret af deres strukturer. Dette er et godt eksempel på, hvor kryo-elektronmikroskopi kan have yderligere fordele."
At kende strukturen af proteinet i detaljeringsgraden, som Leeds-forskerne har leveret, og måling af disse forskelle i forskellige typer af amyloid sygdom og forskellige patienter, kunne også tillade læger at vise, hvem der ville være mest udsat, hvilket betyder, at behandlingen kan målrettes dem, der har mest brug for det.
Det næste skridt for videnskabssamfundet er at begynde at identificere og udvikle inhibitorer - forbindelser, der kan kontrollere proteinsamling til amyloid. Professor Radford har sikret sig næsten 2 millioner pund fra Wellcome til at udføre denne udviklingsfase.
Yderligere laboratorieforsøg, kliniske forsøg, myndighedsgodkendelse og involvering af en lægemiddeludvikler vil stadig være påkrævet, før lægemidler kan bringes på markedet, men de væsentlige skridt fremad i billedklarhed og forståelse af amyloidfoldningsstrukturen markerer et stort spring fremad.
Hele forskningspapiret Strukturen af en β2-mikroglobulinfibril antyder en molekylær basis for dens amyloide polymorfi er offentliggjort i Naturkommunikation .
 Varme artikler
Varme artikler
-
 Fremme i forståelsen af all-solid-state batterierSkematisk af Li-metal/Li6PS5Cl-grænsefladen cyklet ved en samlet strømtæthed over CCS. Kredit: Naturmaterialer (2019) All-solid-state batterier, et batteridesign bestående af alle solide komponen
Fremme i forståelsen af all-solid-state batterierSkematisk af Li-metal/Li6PS5Cl-grænsefladen cyklet ved en samlet strømtæthed over CCS. Kredit: Naturmaterialer (2019) All-solid-state batterier, et batteridesign bestående af alle solide komponen -
 Russiske videnskabsmænd udvikler teknologi til produktion af gennemsigtigt aluminiumKredit:National Research Nuclear University Specialister fra National Research Nuclear University MEPhI og multi-institutionelle samarbejdspartnere har udviklet en teknologi til at producere kompa
Russiske videnskabsmænd udvikler teknologi til produktion af gennemsigtigt aluminiumKredit:National Research Nuclear University Specialister fra National Research Nuclear University MEPhI og multi-institutionelle samarbejdspartnere har udviklet en teknologi til at producere kompa -
 Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr
Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr -
 Forskere præsenterer ny strategi for at udvide duktiliteten i en enfaset legeringA. Multilevel heterogen struktur af enfaset CrCoNi medium entropi-legering efter træktest:korn på størrelse med mikrometer (hvide), submikronkorn (blå), nanokorn (farvede). Nanograin dannes ved korngr
Forskere præsenterer ny strategi for at udvide duktiliteten i en enfaset legeringA. Multilevel heterogen struktur af enfaset CrCoNi medium entropi-legering efter træktest:korn på størrelse med mikrometer (hvide), submikronkorn (blå), nanokorn (farvede). Nanograin dannes ved korngr
- Daimler siger, at han skal betale en bøde på 870 millioner euro for tilbagekaldelse af diesel
- Påvirker opvarmningen i Arktis ekstremt vejr i Storbritannien?
- Dawn identificerer alder af Ceres lyseste område
- Forskellen mellem varme og kolde molekyler
- Opsluger af planeter? Forskere døber stjernen Kronos
- Skrive fremtiden for omskrivbar hukommelse


