Chiralitet af vitamin D-derivat påvirker protonationstilstandene af dets receptorprotein
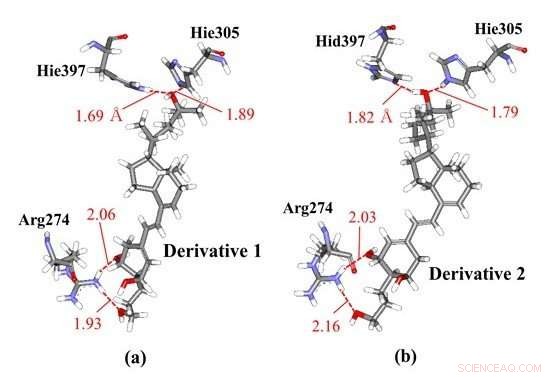
Hydrogenbindingsinteraktioner mellem vitamin-D-derivater og aminosyrerester i VDR; (a) derivat 1 og (b) derivat 2, der har de samme kemiske strukturer, men forskellige chiraliteter. Vores ab initio molekylære simuleringer viste, at derivat 1 interagerer med Hie397 og Hie305, mens derivat 2 interagerer med forskellige protonerede histidinrester, såsom Hid397 og Hie305, hvilket indikerer, at forskellen i chiralitet af derivaterne kan inducere ændringer i histidin-protonationstilstande af VDR-proteinet. Kredit:Toyohashi University of Technology
Forskere ved Toyohashi University of Technology, i samarbejde med forskere ved Teijin Pharma Ltd. og Teikyo University, har fremhævet muligheden for, at chiralitet af vitamin D-derivater kan påvirke protonationstilstandene af histidinrester i vitamin D-receptorproteinet via ab initio molekylære simuleringer og biomedicinske analyser. Dette fund understreger, at protonationstilstande bør overvejes mere præcist i molekylære simuleringer, når man undersøger specifikke interaktioner mellem kandidatlægemidler og målproteiner relateret til sygdomspatogenese.
D-vitamin spiller mange vigtige roller i starten af immunologiske sygdomme, samt regulering af calciumniveauet i blodet. Disse fysiologiske virkninger forårsaget af aktivt D-vitamin udløses af den specifikke interaktion mellem aktivt D-vitamin og D-vitaminreceptoren (VDR); mange typer af vitamin D-derivater er blevet udviklet som potente ligander mod VDR. Bindingsaffiniteten mellem human VDR og vitamin D-derivater er blevet rapporteret at afhænge signifikant af derivatets chiralitet.
Imidlertid, årsagen til afhængigheden er ikke klarlagt, hvilket gør det til en flaskehals i udviklingen af nye og potente lægemidler mod immunologiske sygdomme, hvis begyndelse er relateret til aktiveringen af VDR.
Nu, forskere ved Institut for Datalogi og Teknologi ved Toyohashi University of Technology og ved Teijin Pharma Ltd. og Teikyo University har påvist muligheden for, at D-vitamin-derivatets chiralitet kan påvirke protonationstilstandene af histidinrester i VDR-proteinet baseret på resultaterne evalueret af state-of-the-art molekylære simuleringer og K-computeren fra RIKEN.
Forskere har observeret de specifikke interaktioner mellem VDR og nogle vitamin D-derivater med forskellige chiraliteter ved hjælp af ab initio fragment molecular orbital (FMO) beregninger. FMO-resultaterne afslører, at to histidinrester i VDR bidrager væsentligt til bindingen af VDR med derivaterne, og at protonationstilstandene af disse rester kan påvirke de specifikke interaktioner. Derfor, forskerne overvejede de andre mulige protonationstilstande af disse histidinrester og bestemte de mest stabile tilstande ved hjælp af ab initio FMO-beregninger. Resultaterne illustrerede, for første gang, muligheden for, at forskellen i chiraliteterne af vitamin D-derivater kan inducere ændringer i protonationstilstande af histidinresterne i VDR, der eksisterer nær derivatet. På grund af denne ændring i protonationstilstanden, derivaterne kan binde stærkere til VDR og kan dermed producere mere stabile komplekser med det.
Dette fund giver en vigtig og essentiel advarsel til de molekylære simuleringer for at overveje protonationstilstande af histidinrester i proteiner mere præcist, mens de specifikke interaktioner mellem proteiner og ligander undersøges.
"Vi har brugt sofistikerede molekylære simuleringer og K-computeren til at finde ud af, at protonationstilstandene for histidinresterne i VDR ændrer sig væsentligt med ændringer i ligandens chiralitet, " forklarer lektor Noriyuki Kurita, "Da histidinrester findes i mange proteiner involveret i patogenesen af sygdomme, vi bør overveje deres protonationstilstande mere præcist via in silico lægemiddeldesign baseret på molekylære simuleringer."
Den første forfatter, kandidatstuderende Yuta Terauchi, sagde, "Our final goal is to develop novel and potent drugs capable of activating VDR based on our ab initio molecular simulations, as well as on the basis of biomedical studies performed by our collaborators."
The authors are participating in an in silico drug design consortium—the fragment molecular orbital drug design (FMODD) consortium—in which various researchers from universities, drug companies, and national institutes are investigating the specific interactions between disease-related proteins and many types of candidate drugs using ab initio molecular simulations based on the FMO method and the K computer. Similar molecular simulations are underway now for a huge number of vitamin D derivatives in order to propose novel ligands for VDR, which can act as candidate for potent drugs against immunological diseases, such as cancer.
 Varme artikler
Varme artikler
-
 Syntese af nye røde fosfor med et smart materiale som værtsmaterialeLTT-phosphor (venstre), LNT-phosphor (højre). Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology brugte et materiale med en unik periodisk str
Syntese af nye røde fosfor med et smart materiale som værtsmaterialeLTT-phosphor (venstre), LNT-phosphor (højre). Kredit:Toyohashi University of Technology Professor Hiromi Nakano fra Toyohashi University of Technology brugte et materiale med en unik periodisk str -
 Med denne nye alfa-gel, cremen af alle hudcremer kunne være herForskere fra Tokyo University of Science udvikler et miljøvenligt og let producereligt overfladeaktivt middel til at lave en effektiv vandfastholdende blanding, der kan bruges i hudpleje Kredit:Tokyo
Med denne nye alfa-gel, cremen af alle hudcremer kunne være herForskere fra Tokyo University of Science udvikler et miljøvenligt og let producereligt overfladeaktivt middel til at lave en effektiv vandfastholdende blanding, der kan bruges i hudpleje Kredit:Tokyo -
 Mikroskopiske vogne leverer molekyler i vores cellerDynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle G
Mikroskopiske vogne leverer molekyler i vores cellerDynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle G -
 Genovervejelse af skadeproduktion og strålingsblanding i materialerTil venstre:Illustration af antallet af defekter i materialer forudsagt af den gamle Kinchin-Pease-ligning; Til højre:Illustration af det faktiske antal resterende skader, i overensstemmelse med forud
Genovervejelse af skadeproduktion og strålingsblanding i materialerTil venstre:Illustration af antallet af defekter i materialer forudsagt af den gamle Kinchin-Pease-ligning; Til højre:Illustration af det faktiske antal resterende skader, i overensstemmelse med forud
- Fakta om sæler til børn
- Qualcomm hævder, at Apple har givet chip-hemmeligheder til Intel
- Ny tilgang til bæredygtigt byggeri tager form i Boston
- FN's skovrydningsordning under lup efter Indonesiens debacle
- Regnvandsdamme er ikke en væsentlig kilde til drivhusgasemissioner
- Nyt piezoelektrisk materiale forbliver effektivt til høje temperaturer


