Mikroskopiske vogne leverer molekyler i vores celler
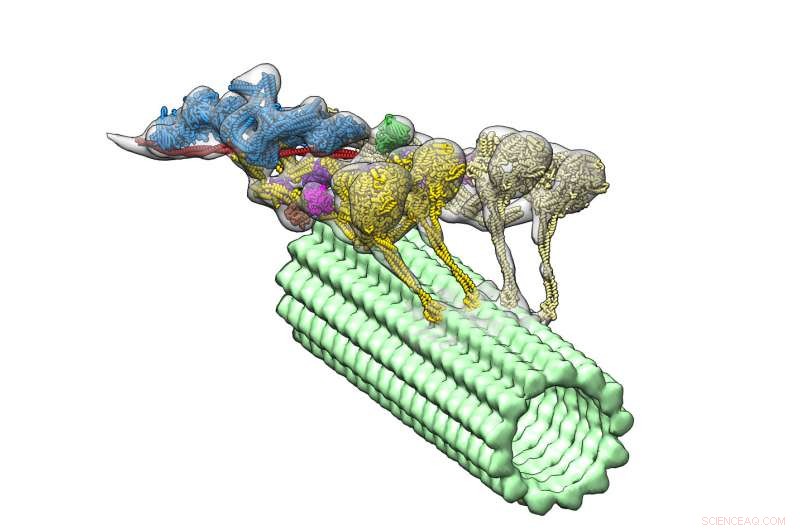
Dynein-dynactin-komplekset (flerfarvet) driver ned i en mikrotubuli (grøn). De fire motordomæner er vist med gult. Dynactin (blå) udgør stilladset for at holde de to dyneiner sammen. Kredit:Danielle Grotjohn, Lander Lab
På den mobile motorvej, motorproteiner kaldet dyneiner styrer vejen. Dyneiner "går" langs strukturer kaldet mikrotubuli for at levere cellulær last, såsom signalmolekyler og organeller, til forskellige dele af en celle. Uden dynein på jobbet, celler kan ikke dele sig, og mennesker kan udvikle neurologiske sygdomme.
Nu en ny undersøgelse, som står i journalen Naturens strukturelle og molekylære biologi , giver den første tredimensionelle (3D) visualisering af dynein-dynactin-komplekset bundet til mikrotubuli. Studielederne fra The Scripps Research Institute (TSRI) rapporterer, at et protein kaldet dynactin kobler to dyneiner sammen, som et åg, der låser et par trækheste sammen.
"Hvis du vil have et hold heste til at bevæge sig i én retning, du skal stille dem op, " siger Gabriel C. Lander, PhD, en TSRI-lektor og seniorforfatter af undersøgelsen. "Det er præcis, hvad dynactin gør ved dynein-molekyler."
At forstå, hvordan dynein-dynactin-komplekset er samlet og organiseret, giver et kritisk grundlag for at forklare de underliggende årsager til adskillige dynein-relaterede neurodegenerative sygdomme såsom spinal muskelatrofi (SMA) og Charcot-Marie-Tooth (CMT) sygdom.
Forskere vidste, at dynactin er påkrævet for at dynein kan flytte last, men de kæmpede for at få et fuldstændigt billede af, hvordan de forskellige dele af komplekset arbejdede sammen.
"Vi vidste, at dynein først bliver aktivt, når det binder sig til en partner kaldet dynactin. Problemet var, at historisk set, det var svært at løse denne struktur, fordi den er meget fleksibel og dynamisk, " forklarer Danielle Grotjahn, en TSRI kandidatstuderende og medførsteforfatter af undersøgelsen. "Vi var nødt til at visualisere disse dynein-dynactin-komplekser for grundlæggende at forstå, hvordan det fungerer at transportere molekyler."
Til den nye undersøgelse, forskere brugte en billeddannelsesteknik kaldet kryo-elektron tomografi, som svarer til at få en CT-scanning af et protein, at producere en 3D-rekonstruktion, eller tomogram. For at øge opløsningen og klarheden af disse tomogrammer, forskere brugte avancerede beregningsalgoritmer til at sammensætte mange individuelle proteinkomplekser.
I dette tilfælde, imidlertid, de nuværende behandlingsmetoder var ikke i stand til at producere en klar, fortolkelig 3D-struktur af det ekstremt fleksible dynein-dynactin-kompleks.
Grotjahn vidste, at de nødvendige oplysninger var skjult i tomogrammerne, så hun udviklede en ny strategi til at identificere specifikke komponenter i dynein-dynactin-komplekset. Denne tilgang hjalp med at guide billedbehandlingssoftwaren til at rekonstruere hele det mikrotubuli-bundne motorkompleks.
"Danielle tog det første store skridt for beregningsalgoritmerne, " siger Lander.
Med deres nye, detaljeret struktur, forskerne bemærkede et overraskende træk:komplekset har to dynein-molekyler, hvor de forventede kun at se et. Dette betyder, at hver dynein har to motoriske domæner, dynein-dynactin-komplekset har fire motoriske domæner i alt.
"Denne opdagelse var fuldstændig uventet, og vil ændre, hvordan dette motoriske kompleks er repræsenteret i cellebiologi og biokemi lærebøger, " siger Saikat Chowdhury, PhD, en TSRI-forsker og medforfatter af undersøgelsen.
"Der havde været år med biofysiske eksperimenter og biokemiske eksperimenter, og det blev altid antaget, at der kun var et dynein-molekyle, " tilføjer Lander.
Forskerne kunne også se, hvor dynactin passede ind. De fandt ud af, at molekylet giver et stabilt stillads, samle holdet af motoriske domæner og aktivere deres evne til at bevæge sig langs mikrotubuli. Denne opdagelse hjælper med at forklare, hvordan dynein kan trække store læs, såsom organeller, der er meget større end dem selv, over lange afstande i et overfyldt cellulært miljø.
Billedbehandlingstilgangen brugt i denne undersøgelse har potentialet til at være yderst nyttig til at løse strukturerne i andre store, fleksible proteiner.
"Vi er nu i stand til at bevæge os forbi tegneseriemodeller og visualisere de fine detaljer i mange dynamiske makromolekylære komplekser, " siger Grotjahn. "Når vi lærer mere om 3D-organisationen og arkitekturen af disse molekylære maskiner, vi vil være bedre rustet til at forstå, hvordan de fungerer dårligt ved sygdom."
Yderligere forfattere af undersøgelsen, "Cryo-elektron tomografi afslører, at dynactin rekrutterer et hold af dyneiner til progressiv motilitet, " var Yiru Xu fra Scripps Research Institute; Richard J. McKenney fra University of California, Davis; og Trina A. Schroer fra Johns Hopkins University.
 Varme artikler
Varme artikler
-
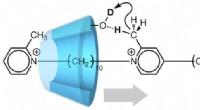 Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist
Molekylær maskine udnytter bevægelse i en enkelt retningFig.1. En pseudo-rotaxan (kunstig molekylær maskine), hvor translationel bevægelse af α-cyclodextrin (α-CD) falder sammen med deuteration. Når α-CD bevæger sig langs to-stationsaksemolekylet som vist -
 Formændrende element har nøglen til antibakteriel belægningAfbildet fra venstre til højre:University of Canterbury ph.d.-studerende Rukmini Gorthy og Johann Land og forskningsleder Maskin- og materialteknik Professor Susan Krumdieck er medforfattere på et pap
Formændrende element har nøglen til antibakteriel belægningAfbildet fra venstre til højre:University of Canterbury ph.d.-studerende Rukmini Gorthy og Johann Land og forskningsleder Maskin- og materialteknik Professor Susan Krumdieck er medforfattere på et pap -
 Forskere skaber titaniumdele ved hjælp af additivteknologierProf. M. Samodurova, Leder af SUSU International Laboratory of Mechanics, Laserprocesser og digitale produktionsteknologier. Kredit:SUSU Fremstilling af produkter af titanium og dets legeringer ve
Forskere skaber titaniumdele ved hjælp af additivteknologierProf. M. Samodurova, Leder af SUSU International Laboratory of Mechanics, Laserprocesser og digitale produktionsteknologier. Kredit:SUSU Fremstilling af produkter af titanium og dets legeringer ve -
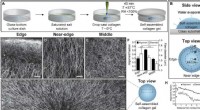 Marangoni-strømme driver justeringen af fibrillære celleladede hydrogelerSelvsamling af kollagen i fordampende dråber genererer afstemte netværk af kollagenfibre. Skematisk af (A) drop-casting procedure og (B) ovenfra og fra siden af en fordampende dråbe kollagen. CRM-bi
Marangoni-strømme driver justeringen af fibrillære celleladede hydrogelerSelvsamling af kollagen i fordampende dråber genererer afstemte netværk af kollagenfibre. Skematisk af (A) drop-casting procedure og (B) ovenfra og fra siden af en fordampende dråbe kollagen. CRM-bi
- Truslen om centaur solsystemobjekter for Jorden
- Demonstrerer hvirvler som Brownske partikler i turbulente strømme
- Ultrahurtig sondering afslører indviklet dynamik af kvantekohærens
- Ny undersøgelse forklarer, hvorfor superledning finder sted i grafen
- Bioøkonomier sigter mod at blive et bankende hjerte i lokalsamfund, både landdistrikterne og byern…
- Team udforsker objekter og processer i nanoskala med mikrobølgemikroskopi


