Kemikere finder et nyt værktøj til at forstå enzymer – Google
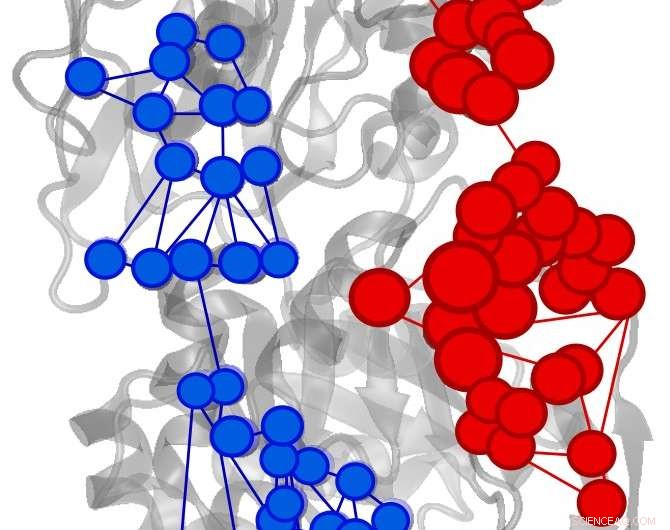
Effektorudløst stigning (rød) eller reduktion (blå) af informationsstrømmen i IGPS-enzym. Kredit:Uriel Morzan
Yale-forskere har taget en ny tilgang til at optrevle den komplekse struktur og regulering af enzymer:De Googlede det.
I en ny undersøgelse offentliggjort online i denne uge i Proceedings of the National Academy of Sciences , kemiprofessor Victor Batista og hans kolleger brugte Google-algoritmen PageRank til at identificere vigtige aminosyrer i reguleringen af et bakterielt enzym, der er vigtigt for de fleste mikroorganismer.
Enzymer er biomolekyler med den unikke evne til at accelerere kemiske reaktioner, der er nødvendige for livet. Selvom disse kemiske reaktioner normalt finder sted i en lille del af enzymet - kendt som det aktive sted - reguleres accelerationen af reaktionen normalt af bindingen af et molekyle i en anden del af enzymet. Bindingspositionen er kendt som det allosteriske sted.
På trods af årtiers studier, det er stadig dårligt forstået, hvordan information overføres fra det allosteriske websted til det aktive websted. En stor del af vanskeligheden har at gøre med det store antal involverede atomer og den store strukturelle fleksibilitet af enzymer.
Yale-holdet bemærkede, at et lignende spørgsmål var blevet behandlet år tidligere inden for computervidenskab. Forskere hos Google havde undersøgt informationsstrømmen på internettet, ved at bruge PageRank til at angive vigtigheden af hver webside med hensyn til antallet og kvaliteten af links til andre internetsider.
"Dette problem er fuldstændig analogt med udvekslingen af information mellem fjerne steder, der karakteriserer allosterisme, sagde Uriel Morzan, en postdoc i Batistas laboratorium og medforfatter af undersøgelsen. "Ved at finde ud af, hvordan informationen strømmer gennem hvert atom ændres med bindingen af en allosterisk aktivator til enzymet, det er muligt at finde de informationskanaler, der bliver aktiveret."
Yale-forskerne identificerede vigtige aminosyrer til den allosteriske proces i imidazolglycerolphosphatsyntase (IGPS), et bakterielt enzym, der findes i de fleste mikroorganismer.
Forskningen baner vejen for yderligere eksperimenter relateret til IGPS-aktivitet, der kan føre til udvikling af nye antibiotika, pesticider, og herbicider.
"Det er spændende, at datavidenskabelige metoder begynder at trænge ind i feltet teoretisk kemi, at give nye værktøjer til at forstå grundlæggende aspekter af katalytiske molekylære systemer, når de kombineres med avancerede molekylær dynamik simuleringer og kernemagnetisk resonans (NMR) spektroskopi, " sagde Batista, som også er medlem af Energy Sciences Institute på Yale's West Campus.
Medforfatter J. Patrick Loria, en Yale professor i kemi og i molekylær biofysik og biokemi, tilføjet:"Det er den synergistiske kombination af eksperimentel NMR og beregningsværktøjer, der muliggør denne dybere indsigt i biologisk funktion og demonstrerer vigtigheden af samarbejde mellem teoretikere og eksperimenter."
 Varme artikler
Varme artikler
-
 Forskere laver kraftfuld undervandslim inspireret af havbarn og muslingerModelfly monteret med silkebaseret lim. Kredit:Marco Lo Presti, Tufts University Hvis du nogensinde har prøvet at hugge en musling ud af en havmur eller et fjeder af bunden af en båd, du vil for
Forskere laver kraftfuld undervandslim inspireret af havbarn og muslingerModelfly monteret med silkebaseret lim. Kredit:Marco Lo Presti, Tufts University Hvis du nogensinde har prøvet at hugge en musling ud af en havmur eller et fjeder af bunden af en båd, du vil for -
 Ingeniører bruger Tiki fakler til undersøgelse af sod, diesel filtrePrøvekerner fra partikelfiltre, der bruges til test. Kredit:University of Notre Dame Kemiske ingeniører testmetoder til forbedring af dieselmotorers effektivitet og samtidig opretholde ydeevnen få
Ingeniører bruger Tiki fakler til undersøgelse af sod, diesel filtrePrøvekerner fra partikelfiltre, der bruges til test. Kredit:University of Notre Dame Kemiske ingeniører testmetoder til forbedring af dieselmotorers effektivitet og samtidig opretholde ydeevnen få -
 Bærbar sensor overvåger sundhed, administrerer medicin ved hjælp af spyt og tårerKredit:Unsplash/CC0 Public Domain En ny slags bærbar sundhedsenhed vil levere medicinske data i realtid til dem med øjen- eller mundsygdomme, ifølge Huanyu Larry Cheng, Dorothy Quiggle Karriereudv
Bærbar sensor overvåger sundhed, administrerer medicin ved hjælp af spyt og tårerKredit:Unsplash/CC0 Public Domain En ny slags bærbar sundhedsenhed vil levere medicinske data i realtid til dem med øjen- eller mundsygdomme, ifølge Huanyu Larry Cheng, Dorothy Quiggle Karriereudv -
 Hvordan fiskeskind og alger kunne hjælpe med at løse plastikforureningskrisenProduktdesignstuderende Lucy Hughes har opfundet en bioplast skabt af fiskeskind og skæl og røde alger. Kredit:University of Sussex En studerende fra University of Sussex har hentet inspiration fr
Hvordan fiskeskind og alger kunne hjælpe med at løse plastikforureningskrisenProduktdesignstuderende Lucy Hughes har opfundet en bioplast skabt af fiskeskind og skæl og røde alger. Kredit:University of Sussex En studerende fra University of Sussex har hentet inspiration fr
- Grønt lys til ultrafine displayfarver
- Vibrationsenergi hemmeligheden bag selvdrevet elektronik
- Tilstedeværelse, karakterer, avancerede kurser forudsiger bedst, om HISD-studerende vil gå på col…
- Hvor mange ark papir kan der produceres fra et enkelt træ?
- Forklarer:Hvorfor gravitationsbølgeforskere vandt en Nobel
- Hvorfor sidder fugle på elektriske ledninger?


