Metode til at undersøge, hvordan bakterier reagerer på sult, probe cellevækst
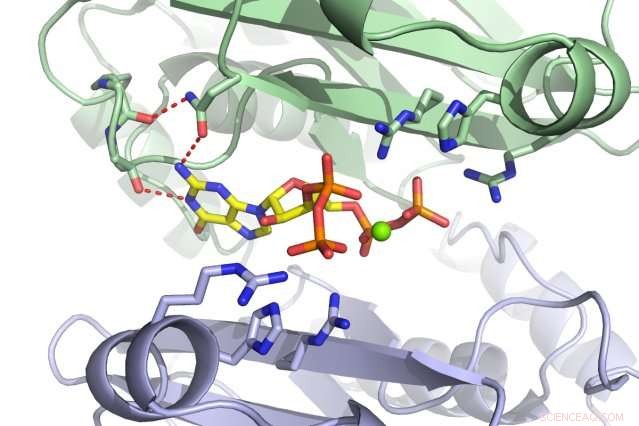
Et MIT-hold har opdaget, at det lille molekyle ppGpp (rødt) binder til PurF-enzymet (underenheder vist i grønt og lilla). Kredit:Massachusetts Institute of Technology
I 1969, videnskabsmand Michael Cashel analyserede forbindelser, der blev produceret af sultede bakterier, da han bemærkede to pletter, der dukkede op på hans kromatogram, som ved en magi. I dag, vi kender et af disse "magiske pletter, "som forskere kalder dem, som guanosintetraphosphat, eller ppGpp for kort. Vi forstår også, at det er et signalmolekyle, der findes i stort set alle bakterier, hjælper med at justere cellevækst og størrelse baseret på tilgængelighed af næringsstoffer.
Og stadigvæk, trods årtiers studier, præcis hvordan ppGpp regulerer bakterievækst er forblevet ret mystisk. Delving kræver yderligere en mere omfattende liste over de molekyler, som ppGpp binder for at udøve sine virkninger.
Nu, samarbejdspartnere fra MIT's afdelinger for biologi og kemi har udviklet en metode til at gøre netop det, og brugte deres nye tilgang til at udpege over 50 ppGpp-mål i Escherichia coli - omkring halvdelen, som ikke var blevet identificeret tidligere. Mange af disse mål er enzymer, der kræves for at producere nukleotider, byggestenene i DNA og RNA. I tider, hvor bakterierne ikke har nok næringsstoffer til at vokse og dele sig normalt, forskerne foreslår, at ppGpp forhindrer disse enzymer i at skabe nye nukleotider fra bunden, hjælper celler med at komme ind i en dvaletilstand.
"Med små molekyler eller metabolitter som ppGpp, Det har historisk set været svært at bestemme, hvilke proteiner de binder, " siger Michael Laub, professor i biologi, en Howard Hughes Medical Institute-efterforsker, og den seniorforfatter af undersøgelsen. "Dette har været et vanskeligt problem, der har holdt feltet tilbage i nogen tid, men vores nye tilgang giver dig mulighed for at finde de sandsynlige mål i løbet af få uger."
Postdoc Boyuan Wang er den første forfatter til undersøgelsen, som optræder i Naturens kemiske biologi den 17. dec.
Det magiske sted
Siden ppGpp blev opdaget for næsten 50 år siden, det har vist sig at undertrykke DNA-replikation, transskription, oversættelse, og forskellige metaboliske veje. Det sætter bremser på cellevækst og tillader bakterier at fortsætte i mødet med sult, stress, og antibiotika. Dens indflydelse på adskillige reguleringsprocesser er forblevet noget af et mysterium, dog - trods alt det modulerer ikke bare en enkelt vej, men koordinerer flere operationer samtidigt for at orkestrere en masselukning af cellen.
For at skelne hvilke proteiner ppGpp binder for at bevirke en sådan udbredt ændring, forskerne byggede, hvad de kalder "capture compounds", der indeholder ppGpp, giver dem mulighed for at fiske sine mål ud fra bakterieekstrakter. Disse forbindelser inkluderede en fotoreaktiv tværbinder, der låste sig tæt til proteinerne af interesse i nærvær af lys, og et biotinhåndtag, der hjalp forskerne med at trække proteinerne ud for at identificere dem. Mest vigtigt, de blev knyttet til ppGpp på en sådan måde, at de ikke ville forstyrre dets evne til at binde sig til dets mål. Denne metode er mere effektiv og nøjagtig sammenlignet med mere traditionelle metoder til at skelne ppGpp-mål, som er langt mere besværlige og mangler følsomhed.
"Vores tilgang løser disse problemer, fordi du ikke længere er forpligtet til at udføre sådanne arbejdskrævende protokoller for at identificere ppGpp-mål - og det virker selv i bakterier ud over E. coli, " siger Wang. "Selvom ppGpp er almindelig blandt mange bakteriearter, det ser ud til at udøve sine virkninger gennem forskellige mekanismer, hvilket komplicerer tingene. Vores indfangningsforbindelser giver en måde at optrevle denne mangfoldighed på, og på kort tid."
Sætter bremserne på nukleotidproduktionen
Selvom de 56 ppGpp -mål, Wang identificerede i sin skærm, kontrollerer et utal af cellulære processer, han funderede på enzymet PurF - som starter biosyntesen af purinnukleotider, der bærer adenin- og guaninbaser, også kendt som A og G.
Når bakterier er stressede eller sultede, de går ind i en hvilende tilstand for at overleve. Men blot at begrænse oversættelse og transskription er ikke nok; nukleotider bliver stadig dannet og vil opbygges, hvis deres syntese ikke sættes på pause. Celler kan bygge nukleotider på en af to måder:enten ved at redde eksisterende materialer eller starte helt fra bunden. PurF starter det første trin i sidstnævnte proces, der fører til A- og G-nukleotiderne. Imidlertid, når ppGpp binder sig til PurF, det får enzymet til at ændre sin form, som forhindrer den i at udføre sit arbejde, reducerer således nukleotidproduktionen i cellen.
"Dette er første gang, at et enzym involveret i den specifikke vej eller funktion er blevet identificeret som et ppGpp-mål, " Wang siger. "Hvis du begrænser forbruget af nukleotider, men ikke deres produktion, nukleotidpuljen kommer til at eksplodere, hvilket ikke er godt for cellen. Så vi har vist, at ppGpp faktisk også løser dette problem."
Ud over PurF og andre enzymer, der kræves til nukleotidproduktion, forskerne bemærkede, at ppGpp også binder til mange GTPase-enzymer involveret i translation. Dette kunne indikere en fejlsikker mekanisme, der bremser oversættelsen ved at slå flere, lignende enzymer på en næsten overflødig måde i mødet med sult.
Mens Wang fortsætter med at forfine sin metode, han sigter mod at øge dets specificitet og sikre, at hans indfangningsforbindelser binder til nøjagtig de samme proteiner, som de ville inde i en levende celle. Han håber også at screene for ppGpp-bindende proteiner i andre bakterier, herunder patogener, der er afhængige af ppGpp for at overleve i deres værter og forplante tilstande som tuberkulose.
"Dette er en spændende kemisk tilgang til bedre at forstå funktionen af et længe undersøgt konserveret signalmolekyle i bakterier, " siger Jue Wang, professor i bakteriologi ved University of Wisconsin i Madison, som ikke var involveret i undersøgelsen. "Deres resultater og teknikker er yderst relevante for mange andre bakterier, og vil i høj grad forbedre viden om, hvordan bakterier bruger dette kritiske signalmolekyle til at formidle alt fra at overleve i den menneskelige tarm til at forårsage sygdom."
Laub tilføjer:"Vi opdager stadig nye nukleotidbaserede signalmolekyler i bakterier selv i dag, og hver enkelt af dem kunne i sidste ende derivatiseres på en lignende måde for at identificere deres bindingspartnere."
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
Sidste artikelKunstig intelligens møder materialevidenskab
Næste artikelForskere maksimerer effektiviteten af platin i brændselsceller
 Varme artikler
Varme artikler
-
 Forskere udvikler open source-software til at analysere økonomien ved biobrændstoffer, bioprodukte…Ledende BioSTEAM-softwareudvikler Yoel Cortes-Pena. Kredit:Center for Avanceret Biobrændstof og Bioproduktinnovation (CABBI) Flerårige græsser kan omdannes til alt fra ethanol til bioplast, men de
Forskere udvikler open source-software til at analysere økonomien ved biobrændstoffer, bioprodukte…Ledende BioSTEAM-softwareudvikler Yoel Cortes-Pena. Kredit:Center for Avanceret Biobrændstof og Bioproduktinnovation (CABBI) Flerårige græsser kan omdannes til alt fra ethanol til bioplast, men de -
 En måde at reparere tandemalje påSnapshot af reparationseksperimentet på en menneskelig tand. Kredit:Zhejiang University Et team af forskere fra Zhejiang University og Xiamen University har fundet en måde at reparere menneskelig
En måde at reparere tandemalje påSnapshot af reparationseksperimentet på en menneskelig tand. Kredit:Zhejiang University Et team af forskere fra Zhejiang University og Xiamen University har fundet en måde at reparere menneskelig -
 Thorium-aluminium-kompleks det første med et aktinid-element til at donere elektroner, når det bin…Kemisk Videnskab (2018). DOI:10.1039/C8SC01260A Et lille team af forskere fra University of California, Lawrence Berkeley National Laboratory og LPCNO, Université de Toulouse, har udviklet en måd
Thorium-aluminium-kompleks det første med et aktinid-element til at donere elektroner, når det bin…Kemisk Videnskab (2018). DOI:10.1039/C8SC01260A Et lille team af forskere fra University of California, Lawrence Berkeley National Laboratory og LPCNO, Université de Toulouse, har udviklet en måd -
 Gennembrudssyntesestrategi kan betyde bølge af nye medicinske forbindelserFSU-forskere har udtænkt en strategi til syntetisering af carbocykliske 5-8-5 smeltede ringsystemer, en molekylær struktur med potentielt bredt terapeutisk potentiale. Kredit:Benjamin Moten I farm
Gennembrudssyntesestrategi kan betyde bølge af nye medicinske forbindelserFSU-forskere har udtænkt en strategi til syntetisering af carbocykliske 5-8-5 smeltede ringsystemer, en molekylær struktur med potentielt bredt terapeutisk potentiale. Kredit:Benjamin Moten I farm
- Forskere modellerer superluminous supernova i 2-D for første gang
- Paradokset ved en frielektronlaser uden laseren
- Vand ændrer, hvordan koboltbaseret molekyle gør kuldioxid til lovende kemikalie
- Gamle vejrmønstre i Europa
- Kvasarer som de nye kosmiske standardlys
- Spillerens adfærd i onlinespillet EVE Online kan afspejle det virkelige land


