Belyser, hvordan nitrogenase laver ammoniak
Vandmolekyler bundet tættest på mineralet har en stiv, islignende struktur og kan ikke bevæge sig ind i arrangementer, der muliggør kemiske reaktioner. Vandmolekyler længere fra mineraloverfladen har en mindre begrænset, væskelignende struktur og kan organisere sig for at fremme reaktivitet. Kredit:Environmental Molecular Sciences Laboratory
Et team af forskere ledet af PNNL beregningsforsker Simone Raugei har afsløret ny indsigt om, hvordan dette komplekse enzym gør sit job, finder ud af, at den tilsyneladende spildfulde dannelse af brint har et væsentligt formål. Deres papir, "Kritisk beregningsanalyse belyser den reduktive-elimineringsmekanisme, der aktiverer nitrogenase for N 2 reduktion, " blev offentliggjort i Proceedings of the National Academy of Sciences i november 2018. Raugeis medforfattere er Lance Seefeldt, som har en fælles ansættelse ved PNNL og Utah State University, og Brian Hoffman fra Northwestern University.
Nitrogenase kan omdanne nitrogen til ammoniak ved stuetemperatur og atmosfærisk tryk. Industri, på den anden side, er afhængig af Haber-Bosch-processen, en århundrede gammel teknik med høj temperatur og tryk. Fossile brændstoffer giver typisk energien til denne proces, hvilket er grunden til, at industriel ammoniakproduktion alene tegner sig for mere end 1 % af verdens samlede energirelaterede kulstofemissioner. At forstå, hvad der giver nitrogenase dens bindingsbrydende muskel, kan føre til nye, stimulerende ideer til design af syntetiske katalysatorer til fremstilling af ammoniak.
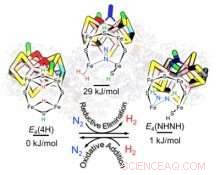
For hvert nitrogenmolekyle, der omdannes til ammoniak, nitrogenase danner mindst et molekyle hydrogen (H 2 ), som er "et af de mest forvirrende mysterier af nitrogenase, " sagde Raugei. "I stedet for bare at producere ammoniak, du producerer også dette biprodukt. Hvorfor er det nødvendigt?"
Forskerne fandt ud af, at dette fænomen faktisk hjælper nitrogenase med at tackle nitrogens stærke bindinger. "Naturen fandt en løsning ved at koble produktionen af brint, som frigiver energi, med spaltende nitrogen, som kræver energi, " sagde Raugei. "Det er total balance."
For at nå frem til resultaterne, holdet brugte en blanding af teoretiske og eksperimentelle metoder. Raugei udførte kvantekemiske beregninger på modeller af kernen af enzymet, afhængig af vejledning fra Seefeldt og Hoffman, som er eksperter i nitrogenases biokemi. Deres eksperimentelle data hjalp med at informere beregningerne, og omvendt.
Forskerne fokuserede på den katalytiske nitrogenasekerne, sammensat af jern, molybdæn og svovl (FeMo-co). Under den katalytiske begivenhed, når FeMo-co har erhvervet et kritisk antal elektroner og protoner (H+) i form af to brodannende hydrider (Fe-H-Fe) i sit perifere bælte, generation af en H 2 bundet til FeMo-co og dets forskydning af N 2 giver og tager energi til at udløse nitrogenreduktion, fandt forskerne.
"Vi var meget godt positioneret til at nå dette gennembrud, fordi vi kombinerede eksperimentel information om nitrogenase med beregningsinformationen, " sagde Raugei. "Det var nøglen."
Forskerne søger at udvide forskningen ved at undersøge de fine detaljer om elektron- og protonakkumulation på det aktive sted for nitrogenase og præcis hvordan N 2 bindingen brydes for at danne ammoniak.
 Varme artikler
Varme artikler
-
 Makromolekylær krystallografi kaster lys over en ny måde at målrette mod malariaparasittenKrystalstruktur af Cryptosporidium parvum Lysyl tRNA-synthetase (CpKRS) bundet til et nyt lille molekyle, der er aktivt mod apicomplexan-parasitterne Plasmodium falciparum og Cryptosporidium parvum.
Makromolekylær krystallografi kaster lys over en ny måde at målrette mod malariaparasittenKrystalstruktur af Cryptosporidium parvum Lysyl tRNA-synthetase (CpKRS) bundet til et nyt lille molekyle, der er aktivt mod apicomplexan-parasitterne Plasmodium falciparum og Cryptosporidium parvum. -
 Forbrugere, quats og COVID-19:Er desinfektionsprodukter sikre?Kredit:CC0 Public Domain I lyset af en vedvarende global pandemi, desinfektionsmidler er vigtigere end nogensinde. Disse produkter er nogle gange afhængige af kvaternære ammoniumforbindelser, elle
Forbrugere, quats og COVID-19:Er desinfektionsprodukter sikre?Kredit:CC0 Public Domain I lyset af en vedvarende global pandemi, desinfektionsmidler er vigtigere end nogensinde. Disse produkter er nogle gange afhængige af kvaternære ammoniumforbindelser, elle -
 Forskeren rapporterer, hvordan seglceller dannes, kan være nøglen til at stoppe demUniversity of Houston lektor i kemi Vassiliy Lubchenko udforsker seglcellesygdom, som påvirker omkring 100, 000 amerikanere, mest afroamerikanere og latinamerikanere. Kredit:University of Houston
Forskeren rapporterer, hvordan seglceller dannes, kan være nøglen til at stoppe demUniversity of Houston lektor i kemi Vassiliy Lubchenko udforsker seglcellesygdom, som påvirker omkring 100, 000 amerikanere, mest afroamerikanere og latinamerikanere. Kredit:University of Houston -
 Vandafdampning Fair Fair ProjectsEn skolevidenskabelige messe er en mulighed for studerende at udforske videnskabelige emner i dybden. Vandfordampning er et sådant emne, som eleverne kan beslutte at vælge. Denne proces involverer mol
Vandafdampning Fair Fair ProjectsEn skolevidenskabelige messe er en mulighed for studerende at udforske videnskabelige emner i dybden. Vandfordampning er et sådant emne, som eleverne kan beslutte at vælge. Denne proces involverer mol
- Silicon giver midler til at styre kvantebits til hurtigere algoritmer
- Nyt syntetisk molekyle kan dræbe influenzavirus
- Vandopløseligt silicium fører til opløselig elektronik
- Embraer deler dyk efter Bolsonaro har udtalt sig forsigtigt over for Boeing-projektet
- Kølende nanorørresonatorer med elektroner
- Astronomer opdager kæmpe relikvie fra den forstyrrede haletudsegalakse


