En uventet virkemåde for et antistof

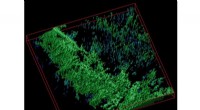
For at illustrere den funktionelle mimik opdaget i antistoffer mod SARS-coronavirus, en mime holder i hånden SARS-CoV S bundet til ACE2-receptoren (blågrøn). Hans refleksion viser et SARS-CoV S bundet til det neutraliserende antistoffragment S230 (lilla). Coronavirusser, der forårsager dødelig atypisk lungebetændelse verden over, kommer ind i målceller via membranfusion ved binding af det virale spike (S) glycoprotein til en værtsreceptor. I den 31. januar, 2019, udgave af Cell, et forskerhold ledet af Alexandra Walls, Xiaoli Xiong, og David Veesler fra University of Washington School of Medicine afslører mekanismerne for neutralisering af SARS-CoV og MERS-CoV af to humane monoklonale antistoffer isoleret fra mennesker, der er kommet sig fra deres infektioner. Undersøgelsen viser, at SARS-CoV S230-antistoffet rekapitulerer virkningen af værtsreceptoren (angiotensin-konverterende enzym 2) ved at fremme fusogene konformationelle ændringer af S-glykoproteinet. Kredit:Jon Klein
Undersøgelser af humane monoklonale antistoffer isoleret fra overlevende af coronavirus-induceret alvorligt akut respiratorisk syndrom (SARS) eller Middle-East respiratory syndrome (MERS) afslører overraskende immunforsvarstaktik mod fatale vira. Atom- og molekylær information om de meget potente antistoffers virkemåde kan give indsigt i at forhindre disse alvorlige og nogle gange dødelige lungeinfektioner.
I øjeblikket, ingen vacciner eller specifikke behandlinger er tilgængelige for nogen af de seks coronavirus, der kan inficere mennesker. Nogle af disse coronavirus forårsager kun almindelige forkølelseslignende symptomer, men andre fremkalder dødelige lungebetændelser. Tidligere dødelige udbrud i flere lande varsler muligheden for coronavirus-medierede pandemier.
Derudover genetisk overvågning af coronavirus hos flagermus, og det faktum, at MERS-coronavirus naturligt cirkulerer i dromedarkameler, tyder på, at tidligere udbrud måske ikke er usædvanlige forekomster. Dyre/menneskelige arter-barrieren vil sandsynligvis blive krydset igen og føre til nye nye coronavirusser i fremtiden.
Som en del af forventnings- og forberedelsesinitiativer, forskningsgrupper om infektionssygdomme forsøger at udvikle et anti-coronavirus-arsenal. Et internationalt hold ledet af UW Medicine-forskere er blandt dem, der forsøger at forstå, hvordan SARS- og MERS-coronavirus inficerer mennesker, og hvordan deres tilstedeværelse fremkalder en reaktion fra immunsystemet. Forskergruppen er især interesseret i, hvordan neutraliserende antistoffer retter sig mod coronaviruss celleinvasionsmaskineri.
Deres seneste resultater vises i onlineudgaven af 31. januar Celle . De første forfattere er Alexandra Walls og Xiaoli Xiong, og hovedforfatteren og seniorforfatteren er David Veesler, alle fra Institut for Biokemi ved University of Washington School of Medicine.
Coronaviruss har multifunktionelle overfladespidser, der genkender og binder sig til receptorer på overfladen af en værtscelle. De smelter derefter virussen og cellemembranerne sammen. De bruger disse trimere spike glycoproteiner som deres molekylære indbrudsværktøj.
Spike-glykoproteinet dekorerer tæt overfladen af coronavirus. De talrige fremspring ligner grater på en frøstand. Piggene er nøglen til infektiviteten og patogeniciteten af coronavirus. De er målet for neutraliserende antistoffer og hovedfokus for underenhedsvaccinedesign.
Tidligere undersøgelser i Veesler-laboratoriet på UW Medicine så på de strukturelle tilstande, der forekommer i coronavirus-spidsen før og efter membranfusionsreaktionen. Forskerne så store konformationelle ændringer i spike-glykoproteinet. Detaljer om aktivering af membranfusionskaskaden, imidlertid, forblev uklart.
Ved hjælp af kryo-elektronmikroskopi og andre kraftfulde teknologier, forskerne fik indsigt i, hvordan de neutraliserende monoklonale antistoffer fra SARS- og MERS-overlevende hæmmer vira på molekylært niveau. Deres resultater hjalp også med at belyse den usædvanlige karakter af aktivering af coronavirus-membranfusion.
Forskerne fandt ud af, at både SARS- og MERS-coronavirus-antistofferne blokerede virusspidserne i at interagere med receptorerne på værtscellemembranen.
SARS-coronavirus-antistoffet gjorde også noget uventet:det efterlignede funktionelt receptorbinding og inducerede spidsen til at gennemgå konformationelle ændringer, der førte til membranfusion. Denne udløser synes at være drevet af en molekylær skraldemekanisme.
"Opdagelsen er et hidtil uset eksempel på funktionel mimik, " bemærkede forskerne, "hvorved et antistof aktiverer membranfusion ved at rekapitulere receptorens virkning."
Denne undersøgelse brugte molekylær billeddannelse til at karakterisere strukturerne af både SARS og MERS coronavirus spike glycoproteiner i et kompleks med deres respektive antistoffer.
Forskerne fremlagde også en plan for de kulhydrater, der dækker toppen af glykoproteinerne, i sammenhæng med hele vira. Coronaviruss bruger denne strategi til at maskere den sårbare del af deres fusionsapparat for at begrænse antistofadgang til det og blot udsætte det for at udføre genkendelse og infektion af værtsceller.
 Varme artikler
Varme artikler
-
 Forskere udvikler et cellulosebiosensormateriale til avanceret vævsteknologiEn 3D-rekonstruktion af en cellulosematrix farvet med en pH-følsom biosensor. Kredit:Dr. R. Dmitriev I.M. Sechenov fra First Moscow State Medical University gik sammen med irske kolleger for at ud
Forskere udvikler et cellulosebiosensormateriale til avanceret vævsteknologiEn 3D-rekonstruktion af en cellulosematrix farvet med en pH-følsom biosensor. Kredit:Dr. R. Dmitriev I.M. Sechenov fra First Moscow State Medical University gik sammen med irske kolleger for at ud -
 Første af sin slags kemisk oscillator tilbyder et nyt niveau af molekylær kontrolKemisk oscillator. Kredit:Ella Maru Studio og Cody Geary DNA -molekyler, der følger specifikke instruktioner, kan tilbyde mere præcis molekylær kontrol af syntetiske kemiske systemer, en opdagelse
Første af sin slags kemisk oscillator tilbyder et nyt niveau af molekylær kontrolKemisk oscillator. Kredit:Ella Maru Studio og Cody Geary DNA -molekyler, der følger specifikke instruktioner, kan tilbyde mere præcis molekylær kontrol af syntetiske kemiske systemer, en opdagelse -
 Kemisk jonglering med tre partiklerDr. Andreas Gansäuer og Anastasia Panfilova under epoxyhydrogenering på Kekulé Institute of Organic Chemistry and Biochemistry ved universitetet i Bonn. Kredit:Volker Lannert/Uni Bonn Kemikere fra
Kemisk jonglering med tre partiklerDr. Andreas Gansäuer og Anastasia Panfilova under epoxyhydrogenering på Kekulé Institute of Organic Chemistry and Biochemistry ved universitetet i Bonn. Kredit:Volker Lannert/Uni Bonn Kemikere fra -
 Duftfrigivende stof kan hjælpe med at neutralisere svedigt træningstøjKredit:American Chemical Society Varmt sommervejr, stressende situationer og intens træning kan forårsage ubehagelig svedig lugt. Men hvad nu hvis tøj kunne dække over disse pinlige lugte med en d
Duftfrigivende stof kan hjælpe med at neutralisere svedigt træningstøjKredit:American Chemical Society Varmt sommervejr, stressende situationer og intens træning kan forårsage ubehagelig svedig lugt. Men hvad nu hvis tøj kunne dække over disse pinlige lugte med en d
- Elektronik integreret i musklen via Kirigami
- Ghanesisk casestudie:Hvordan brudepris forstærker negative stereotyper
- Fælles antioxidantenzym kan give potentiel behandling for COVID-19
- Glaciolog forsøger at kvantificere virkningen af global opvarmning på Asias gletschere
- Hvordan man fortæller forskellen mellem brandmyrer og regelmæssige myrer
- Bevis på en frygtindgydende haj, der tager en pterosaur ned midt på flyvningen


