Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjerteceller

At afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerteceller interaktioner. Venstre mod højre:Vladimir Yarov-Yarovoy, Colleen Clancy, Phuong Tran Nguyen, Igor Vorobyov og Kevin DeMarco Venstre mod højre:Vladimir Yarov-Yarovoy, Colleen Clancy, Phuong Tran Nguyen, Igor Vorobyov og Kevin DeMarco Kredit:UC Regents
At afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, en gruppe forskere ved UC Davis har udviklet nye simuleringer, der giver indsigt i vitale interaktioner mellem lægemidler og hjerteceller på atomare skala.
Disse simuleringer, offentliggjort i dag i PNAS ( Proceedings of the National Academy of Sciences ), kan lede vejen til bedre udvikling af nye antiarytmiske lægemidler rettet mod spændingsstyrede natriumkanaler (NaV), specialiserede proteinmolekyler i hjertecellemembranen.
Natriumkanaler fungerer som gatekeepere, der regulerer hjertecellers elektriske aktivitet. Når de elektriske signaler, der koordinerer hjerteslagene, ikke fungerer korrekt, hjertet kan opleve uregelmæssige hjerteslag og anses for at være i en arytmisk tilstand.
En klasse af antiarytmiske lægemidler virker på NaV-kanaler for at påvirke hjertets elektriske aktivitet og dets slag. Endnu, de langvarige svigt i lægemiddelbehandling af hjerterytmeforstyrrelser stammer hovedsageligt fra manglende evne til at forudsige virkningen af udviklede lægemidler på aktiviteten af NaV og andre hjerte-ionkanaler.
"Før vores undersøgelse, der har ikke været nogen effektiv præklinisk metode til at differentiere nyttige eller potentielt skadelige lægemidler på molekylært niveau, sagde Vladimir Yarov-Yarovoy, lektor ved UC Davis Institut for Fysiologi og Membranbiologi.
"At udvikle og screene nye lægemidler til behandling af hjerte-kar-sygdomme og for at minimere deres bivirkninger, der er behov for at forstå mekanismen for antiarytmiske lægemiddelinteraktioner med NaV-kanaler på atomare skala, " han sagde.
Takket være adskillige teknologiske gennembrud og et stigende antal tilgængelige højopløsningsstrukturer af ionkanaler, såsom NaV, forskere er nu i stand til at simulere disse strukturer og at modulere aktiviteten af hjertecellerne ved at studere deres interaktioner ved atomær opløsning. Forskerne var i stand til at bygge en model af den menneskelige NaV-kanal baseret på den tæt-lignende struktur af den elektriske ål-NaV-kanal ved hjælp af Rosetta-computermodelleringssoftware.
NaV-kanaler åbner for at tillade natriumionerne at strømme ind i hjertecellerne og lukke inden for millisekunder. Når lægemiddelmolekylerne kommer ind i disse kanaler, de binder tæt til receptorstedet i proteinet, hvilket forhindrer natriumionerne i at trænge ind i cellen og blokerer kanalledningen. Denne ændring i ledningsevnen påvirker hjertets elektriske aktivitet og dets slag.
I de udviklede atommodelsimuleringer, to lægemiddelmolekyler ses passere ind i kanalens centrale pore og binde sig til receptorstedet for proteinet, der danner "hot spots", områder, hvor den mest gunstige lægemiddel-protein interaktion forekommer. Denne bindingsaktivitet udløser, hvad der er kendt som en højaffinitetstilstand af kanalen.
"Høj affinitetstilstand af kanalen anses for at være den vigtigste tilstand til at studere lægemiddel-proteinbindingsmekanisme. Nu og for første gang, vi kan forstå, hvordan denne bindingsproces sker på atomær skala, " tilføjede Yarov-Yarovoy.
Multi-mikrosekunderssimuleringer af lidocain (antiarytmisk og lokalbedøvende lægemiddel), der interagerer med natriumkanaler, afslørede en kanalporeadgangsvej gennem den intracellulære gate og en ny adgangsvej gennem en relativt lille lateral åbning kendt som fenestration.
At kombinere molekylær modelleringssoftware med simuleringer for at studere lægemiddelkanal-interaktioner er en ny tilgang, der muliggør fremtidig automatiseret virtuel lægemiddelscreening. Denne teknologi kan anvendes på enhver ionkanal og vil gavne flere behandlinger. Ultimativt, denne tilgang fremmer præcisionsmedicin ved at forudsige individuelle patientresponser på lægemiddelbehandling baseret på den specifikke ionkanalmutation, som patienten har.
 Varme artikler
Varme artikler
-
 Bakterier spiser drivhusgas med en side af proteinMethanobactinstrukturen (i hvid) og MbnB-proteinstrukturen vist i rødt og blåt Kredit:Amy Rosenzweig Lab, Northwestern University Med evnen til at sive tungmetaller fra miljøet og fordøje en poten
Bakterier spiser drivhusgas med en side af proteinMethanobactinstrukturen (i hvid) og MbnB-proteinstrukturen vist i rødt og blåt Kredit:Amy Rosenzweig Lab, Northwestern University Med evnen til at sive tungmetaller fra miljøet og fordøje en poten -
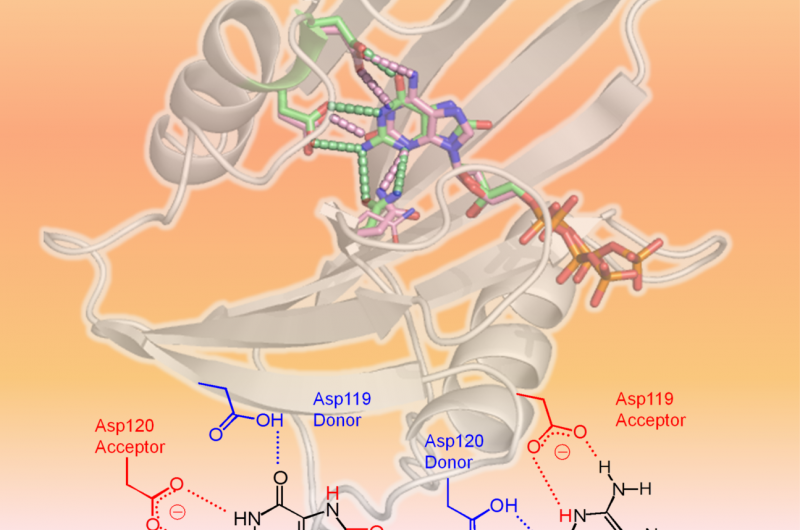 Mekanisme for hMTH1s brede substratspecificitet afslørethMTH1 genkender to oxiderede dNTPer som vist i 3D-strukturen (øverste område af figuren:hMTH1, bånd; beskadigede dNTPer, pinde). Den afgørende faktor i den brede substratspecificitet er forskellige pr
Mekanisme for hMTH1s brede substratspecificitet afslørethMTH1 genkender to oxiderede dNTPer som vist i 3D-strukturen (øverste område af figuren:hMTH1, bånd; beskadigede dNTPer, pinde). Den afgørende faktor i den brede substratspecificitet er forskellige pr -
 Reaktionstype med kobber & salpetersyreReaktionerne mellem kobber og salpetersyre er eksempler på oxidationsreduktionsreaktioner, hvor vinding af elektroner reducerer det ene element og mister dem oxiderer det andet. Salpetersyre er ikke k
Reaktionstype med kobber & salpetersyreReaktionerne mellem kobber og salpetersyre er eksempler på oxidationsreduktionsreaktioner, hvor vinding af elektroner reducerer det ene element og mister dem oxiderer det andet. Salpetersyre er ikke k -
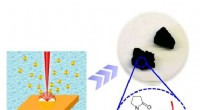 Manipulerende ligander:En ny dimension til fremme af elektrokatalyse ydeevne af ædelmetal aerogelerI lyset af renligheden af laserproducerede metal nanopartikelforstadier, overflade-ren ædelmetal aerogeler er skabt. NMAernes iboende elektrokatalytiske egenskaber belyses, og ligandmodulerede elekt
Manipulerende ligander:En ny dimension til fremme af elektrokatalyse ydeevne af ædelmetal aerogelerI lyset af renligheden af laserproducerede metal nanopartikelforstadier, overflade-ren ædelmetal aerogeler er skabt. NMAernes iboende elektrokatalytiske egenskaber belyses, og ligandmodulerede elekt


