Mekanisme for hMTH1s brede substratspecificitet afsløret
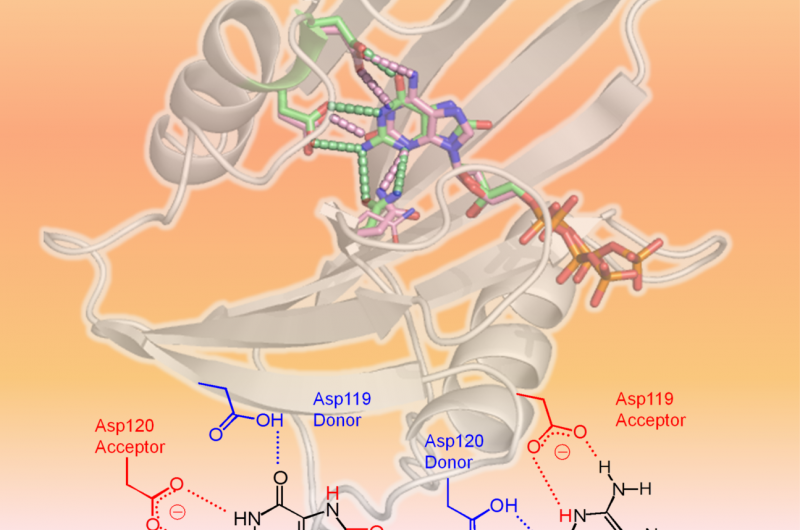
hMTH1 genkender to oxiderede dNTP'er som vist i 3D-strukturen (øverste område af figuren:hMTH1, bånd; beskadigede dNTP'er, pinde). Den afgørende faktor i den brede substratspecificitet er forskellige protonationstilstande mellem Asp-119 og Asp-120 (nederste område af figuren). Kredit:Professor Yuriko Yamagata
Human MutT homolog 1 (hMTH1) protein fungerer som det primære enzym til at nedbryde (hydrolysere) beskadigede (oxiderede) deoxynukleosidtriphosphater (dNTP'er) substraterne for DNA-syntese. For nylig, hMTH1 har tiltrukket sig opmærksomhed som et populært mål for nye kræftbehandlinger, fordi det er ikke-essentielt for normale celler, men kræftceller kræver det for at undgå at inkorporere oxiderede nukleotider i DNA, hvilket vil resultere i kræftcelledød. Nu, hMTH1-hæmmere er udviklet som lægemiddelkandidater mod kræft. Selvom nogle rapporter argumenterer imod nytten af hMTH1-hæmning, meget potente og selektive inhibitorer af hMTH1, som ville give mulighed for introduktion af oxiderede nukleotider i cancercelle-DNA, forventes til fremtidig kræftbehandling.
Enzymer er normalt meget specielle med hensyn til det materiale, de katalyserer (substrat). Nogle, imidlertid, kan katalysere mere end ét substrat, og hMTH1 er kendt for at hydrolysere adskillige oxiderede dNTP'er. Årsagerne bag den brede substratspecificitet var endnu ikke blevet undersøgt, da forskere fra Japan begyndte at overveje spørgsmålet.
Forskere fra Kumamoto University, National Institutes for Quantum and Radiological Science and Technology, og Kyushu University udførte strukturelle og kinetiske analyser på hMTH1 for at bestemme mekanismerne bag dets evne til at hydrolysere forskellige oxiderede mutagene dNTP'er, såsom 8-oxo-dGTP og 2-oxo-dATP, med tilsvarende effektivitet. Deres eksperimenter fandt bevis for, at protonationstilstanden mellem aspartatresterne Asp-119 og Asp-120 var den afgørende faktor i hMTH1's brede substratspecificitet. Med andre ord, tilføjelsen eller fjernelsen af en eller flere protoner ved Asp-119 eller Asp-120 er det, der får hMTH1 til at genkende 8-oxo-dGTP eller 2-oxo-dATP. Dette gør det muligt for hMTH1 at hydrolysere de oxiderede mutagene dNTP'er, før de bruges til DNA-syntese; DNA, der indeholder oxiderede nukleotider, vil forårsage kræftcelledød.
"Vi fandt ud af, at forskellige protonationstilstande mellem Asp-119 og Asp-120 er signalet for hMTH1 til at hydrolysere de beskadigede nukleotider. Hvis denne handling af hMTH1 kan undertrykkes, kræftceller ville akkumulere beskadigede nukleotider og til sidst undergå apoptose, " sagde Kumamoto Universitys professor Yuriko Yamagata, leder af forskningsgruppen. "Afklaringen af denne mekanisme skulle hjælpe med udviklingen af hMTH1-målrettet anticancer-lægemidler."
 Varme artikler
Varme artikler
-
 Molekylær switch registrerer metaller i miljøetNår en metalion indsættes, molekylet ændrer geometri, fungerer som en tænd/sluk-knap. Kredit:UNIGE Et internationalt hold ledet af forskere fra Universitetet i Genève (UNIGE), Schweiz, har designe
Molekylær switch registrerer metaller i miljøetNår en metalion indsættes, molekylet ændrer geometri, fungerer som en tænd/sluk-knap. Kredit:UNIGE Et internationalt hold ledet af forskere fra Universitetet i Genève (UNIGE), Schweiz, har designe -
 Forskere konverterer plast til nyttige kemikalier ved hjælp af sollysKredit:Nanyang Technological University Kemikere ved Nanyang Technological University, Singapore (NTU Singapore) har opdaget en metode, der kan gøre plastaffald til værdifulde kemikalier ved hjælp
Forskere konverterer plast til nyttige kemikalier ved hjælp af sollysKredit:Nanyang Technological University Kemikere ved Nanyang Technological University, Singapore (NTU Singapore) har opdaget en metode, der kan gøre plastaffald til værdifulde kemikalier ved hjælp -
 Enkelte atomer bryder carbons stærkeste bindingBrookhaven videnskabsmand Eli Stavitski er vist ved NSLS-IIs Indre Shell Spectroscopy beamline, hvor forskere afbildede den fysiske og kemiske kompleksitet af en enkelt-atom katalysator, der bryder ku
Enkelte atomer bryder carbons stærkeste bindingBrookhaven videnskabsmand Eli Stavitski er vist ved NSLS-IIs Indre Shell Spectroscopy beamline, hvor forskere afbildede den fysiske og kemiske kompleksitet af en enkelt-atom katalysator, der bryder ku -
 Hvordan lavede de gamle mestre deres ultramarine?XANES resultater for malingprøver fra de fem undersøgte malerier. Mønsteret i venstre side af spektret er en indikation af opvarmningen af lapis lazuli under forberedelsen af ultramarinen. Kredit:
Hvordan lavede de gamle mestre deres ultramarine?XANES resultater for malingprøver fra de fem undersøgte malerier. Mønsteret i venstre side af spektret er en indikation af opvarmningen af lapis lazuli under forberedelsen af ultramarinen. Kredit:
- JEDI opfordrer Europa til at finde innovationskraft
- Unge, der er relativt ældre end deres klassekammerater, er mere populære
- Globale hotspots for potentielle vandkonflikter
- Det bedste fra begge verdener til økonomiske forudsigelser
- Redigeret plantebaseret toksin besidder antitumoregenskaber
- Undersøgelse undersøger, hvad der gør folk modtagelige for falske sundhedsnyheder


