En ny tilgang til at lægge et svært kræftmål
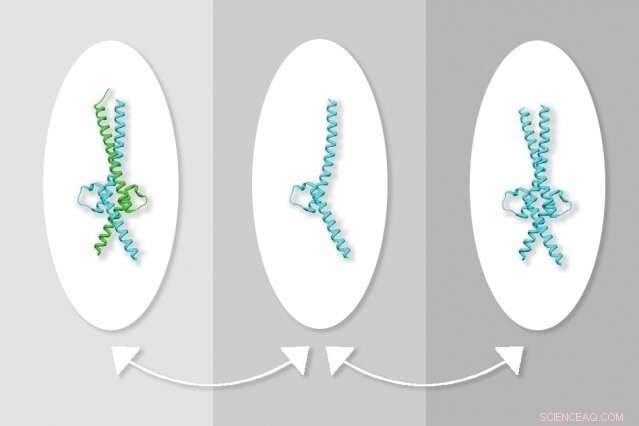
MIT -forskere har opdaget en måde at manipulere interaktionerne mellem proteinerne Myc og Max, som regulerer gentransskription. Til venstre, Myc interagerer med Max, i centrum, Max er alene, til højre, to molekyler af Max. Kredit:Udlånt af forskerne, redigeret af MIT News
Et af de mest almindelige kræftfremmende gener, kendt som Myc, er også en af de sværeste at målrette med stoffer. Forskere har længe forsøgt at udvikle lægemidler, der blokerer Myc-proteinet, men indtil videre har deres indsats ikke været succesfuld.
Nu, bruge en alternativ strategi, MIT-forskere har opdaget en forbindelse, der kan reducere Myc-aktiviteten ved at binde sammen det protein, der er Mycs sædvanlige bindingspartner, efterlader Myc partnerløs og ude af stand til at udføre sine sædvanlige funktioner.
Forskerholdet, ledet af Angela Koehler, en assisterende professor i biologisk ingeniørvidenskab og medlem af MIT's Koch Institute for Integrative Cancer Research, fandt ud af, at den forbindelse, de udviklede, kunne undertrykke tumorvækst hos mus med visse typer kræft. Forbindelsen er blevet licenseret af en MIT -spinout, der nu søger at udvikle mere kraftfulde versioner, der potentielt kan testes hos mennesker.
Koehler er seniorforfatter af undersøgelsen, som vises online i journalen Cellekemisk biologi den 14. marts. MIT postdoc Nicholas Struntz og kandidatstuderende Andrew Chen er hovedforfatterne af undersøgelsen, og forskerholdet omfatter også forfattere fra Broad Institute of MIT og Harvard, Stanford University, Baylor College of Medicine, Brigham and Women's Hospital, og Dana-Farber Cancer Institute.
En ny tilgang
I årtier, kræftforskere har forsøgt at finde måder at lukke Myc på, som er en transkriptionsfaktor - et protein, der styrer ekspressionen af andre gener. Kendt som en "master regulator, " Myc styrer mange gener involveret i basale cellulære funktioner såsom vækst og metabolisme. Når det bliver overudtrykt, som det gør i omkring 70 procent af kræfttilfældene, det driver ukontrolleret cellevækst og -proliferation.
Myc danner normalt en struktur kendt som en heterodimer med Max-proteinet, og disse proteiner binder sammen til DNA for at aktivere gentransskription. Lægemiddeludviklingsindsatsen har traditionelt fokuseret på at forstyrre samspillet mellem Myc og Max, hvilket har vist sig svært. De fleste af de forbindelser, som forskere har testet, har vist sig at være for svage, eller ikke specifik nok til Myc-Max-interaktionen.
Koehler stødte på lignende vanskeligheder, men for flere år siden, hun besluttede at forfølge en anden strategi, baseret på Max-proteinet. Ideen var at forsøge at finde forbindelser, der ville interagere med Max, og se derefter om de havde nogen effekt på Mycs evne til at drive cellevækst.
Ved at bruge en teknologi udviklet af Koehler kendt som et mikroarray-bindingsassay, forskerne screenede et bibliotek på omkring 20, 000 forbindelser, inklusive både naturlige produkter og en samling af forbindelser syntetiseret af Broad Institute, som mulige lægemiddelkandidater. De seks bedste hits, med hensyn til evnen til at binde til Max og hæmme Myc transkriptionel aktivitet i et andet assay, alle kom fra Broad Institute-samlingen.
Forskerne testede forbindelserne i flere forskellige kræftcellelinjer og identificerede en, der syntes at være mest effektiv til at standse cellevækst.
I starten forskerne var usikre på, hvordan denne forbindelse blokerede Myc-aktivitet, men eksperimenter afslørede, at det stabiliserede en struktur, hvor to molekyler af Max binder sammen, danner en struktur kaldet en homodimer. Dette reducerer dannelsen af Myc-Max-heterodimeren og fører til et fald i Myc-niveauer, som forskerne mener kan være resultatet af, at det upartnere protein er blevet nedbrudt i celler.
Krympende tumorer
Forskerne fandt ud af, at forbindelsen bremsede cellevækst i en række forskellige Myc-afhængige humane kræftceller, inklusive modeller for hepatocellulært karcinom, T-celle akut lymfoblastisk leukæmi, og Burkitts lymfom.
De testede også forbindelsen i mus, og fandt ud af, at selvom den forbindelse, de oprindeligt identificerede, ikke var optimeret til maksimal styrke, det kunne bremse tumorprogression i musemodeller af hepatocellulært karcinom og T-celle akut lymfoblastisk leukæmi.
"Opdagelsen og detaljerede validering af et lille molekyle, der er rettet mod Max-homodimerer, repræsenterer et betydeligt fremskridt i forhold til tidligere forsøg på direkte at hæmme enten Myc selv eller Myc-Max-dimerisering, " siger Robert Eisenman, en hovedforsker ved Fred Hutchinson Cancer Research Center, der ikke var involveret i undersøgelsen. "Det giver ikke kun ny indsigt i, hvordan Myc fungerer, men afslører, hvad der sandsynligvis vil være en vigtig sårbarhed, der kan udnyttes i Myc-drevne kræftformer."
Kronos Bio, det selskab, der har givet licens til rettighederne til stoffet beskrevet i dette dokument, arbejder nu på at optimere den til at blive mere potent og mere effektiv. Koehlers laboratorium arbejder også på at lære mere om, hvordan denne forbindelse virker, samt at bestemme strukturen af det kompleks, som det danner med Max homodimeren, i håb om potentielt at udvikle bedre versioner.
"Denne særlige forbindelse vil ikke være et lægemiddel - det er i virkeligheden bare et værktøj til at afklare relevansen af at stabilisere Max homodimerer som en strategi til at forstyrre Myc-funktionen, " siger Koehler. "Det kan vejlede folk i den farmaceutiske industri, der overvejer at prøve at medicinere Myc, måske at tænke på andre måder at finde Max homodimer stabilisatorer på."
Hendes laboratorium forfølger også andre måder at målrette mod Myc, såsom at finde måder at stabilisere en homodimer af to Myc-molekyler, som sandsynligvis ville ende med at blive nedbrudt i cellen.
"Der kan være forskellige måder at stabilisere biomolekylære interaktioner inden for Myc-Max-netværket, som kan føre til forskellige måder at forstyrre Myc-funktionen på, " hun siger.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 Forskere opfinder lim aktiveret af magnetfelt(Venstre til højre) NTU Assoc Prof Terry Steele, Prof Raju V. Ramanujan og Dr. Richa Chaudhary holder forskellige bløde og hårde materialer, der er bundet af deres nye magnethærdende lim, kredit:NTU S
Forskere opfinder lim aktiveret af magnetfelt(Venstre til højre) NTU Assoc Prof Terry Steele, Prof Raju V. Ramanujan og Dr. Richa Chaudhary holder forskellige bløde og hårde materialer, der er bundet af deres nye magnethærdende lim, kredit:NTU S -
 Sådan kombineres kemiske ligningerKemiske ligninger definerer, hvordan specifikke kemikalier interagerer og reagerer med hinanden. Ved enkle reaktioner er den kemiske ligning en enkelt proces, men der forekommer mange komplekse reakti
Sådan kombineres kemiske ligningerKemiske ligninger definerer, hvordan specifikke kemikalier interagerer og reagerer med hinanden. Ved enkle reaktioner er den kemiske ligning en enkelt proces, men der forekommer mange komplekse reakti -
 Skeder driver kraftfulde nye kunstige musklerDenne illustration viser et snoet carbon nanorør-garn (CNT) (venstre) og en kappedrevet kunstig muskel (SRAM) fremstillet ved at belægge et snoet CNT-garn med en polymerskede. Et scanningselektronmikr
Skeder driver kraftfulde nye kunstige musklerDenne illustration viser et snoet carbon nanorør-garn (CNT) (venstre) og en kappedrevet kunstig muskel (SRAM) fremstillet ved at belægge et snoet CNT-garn med en polymerskede. Et scanningselektronmikr -
 Ny metode beregner ligevægtskonstanten i lille skalaBlanding af beregningskemi og teoretisk matematik viste sig at være en vindende formel for Emory-kemikeren James Kindt (i midten), hans kandidatstuderende (fra venstre) Xiaokun Zhang og Lara Patel, og
Ny metode beregner ligevægtskonstanten i lille skalaBlanding af beregningskemi og teoretisk matematik viste sig at være en vindende formel for Emory-kemikeren James Kindt (i midten), hans kandidatstuderende (fra venstre) Xiaokun Zhang og Lara Patel, og
- Forbundsværktøj:Fjernelse af kulaske ville tage 24 år
- Computermodel viser opbrud af isbjerg-logjams
- Grundlæggende komponenter af en HPLC
- Sundhedspersonale er vigtige formidlere til at håndtere klimaændringer
- NASA konstaterer, at tropiske cykloner Vayu bliver strakt
- Friktionslove testet i det kollapsende krater på en vulkan i udbrud


