Undersøgelse afslører mysteriet om antimikrobielle frøsekretioner

Et grafisk sammendrag:Elektrofysiologisk analyse af membranafbrydelse ved hjælp af Bombinin og dets isomer ved hjælp af Lipid Bilayer System. Kreditering:Figuren er tilpasset med tilladelse fra forsiden af ACS Appl. Bio Mater., 2019, 2 (4). Copyright © 2019 American Chemical Society
japanske videnskabsmænd, herunder forskere ved Tokyo University of Agriculture and Technology (TUAT) og Yokohama National University, har identificeret den molekylære mekanisme, der giver en arts hudsekretioner effektive antimikrobielle egenskaber. Deres resultater blev offentliggjort den 20. februar, 2019 i ACS Applied Bio Materials .
Det Bombina variegata frø, også kendt som Yellow Bellied Toad, bor i skovene, græsarealer, vådområder, og akvatiske levesteder i hele Centraleuropa. Deres hudsekreter indeholder antimikrobielle midler - kaldet Bombinin H2 og H4 - som spiller en nøglerolle i at beskytte arten mod infektion.
Bombinin H2 og H4 er antimikrobielle peptider (AMP'er) - eller værtsforsvarspeptider - der spiller en vigtig funktion i immunrespons. De har tiltrukket sig opmærksomhed for deres evne til at hæmme Leishmaniasis, en meget smitsom og potentielt dødelig tropisk sygdom, der har ramt anslået 20 millioner mennesker verden over, med 1,3 millioner nye sager og 20, 000 til 30, 000 dødsfald rapporteret hvert år.
H4 er en isomer af H2 - de deler den samme formel, men atomerne i molekylet er arrangeret anderledes - hvor H4 har en naturligt forekommende D-aminosyre for enden af molekylkæden. Med hensyn til dets antimikrobielle egenskaber, H4 er mere potent end H2, men indtil nu, årsagen er forblevet et uløst biologisk mysterium.
"D- og L-aminosyrer er spejlbilleder af hinanden, og de fleste aminosyrer i naturen har L -struktur, " forklarer Ryuji Kawano, Lektor ved Institut for Bioteknologi og Biovidenskab på TUAT og medforfatter til undersøgelsen. "Nogle få proteiner er modificeret til at have D-aminosyrer. Rollen af at have D-aminosyrer er ikke fuldt ud forstået i tilfælde af frøen."
For at få en bedre forståelse af den molekylære mekanisme, der driver den antimikrobielle aktivitet af Bombinin H2 og H4 peptider, og hvad der gør H4 mere effektiv end H2 i denne henseende, forfatterne udførte elektrofysiologiske eksperimenter på en lipid-dobbeltlagsmembran, der replikerede lipidmembranen omkring celler eller mikroorganismer. Resultaterne blev derefter analyseret ved hjælp af eksisterende AMP-modeller for at bestemme, hvor effektive disse antimikrobielle peptider er til at forstyrre mikrobers cellemembran.
Teamet fandt ud af, at H2- og H4 -peptider hæmmer mikrobiel aktivitet ved at lave huller i cellemembranen af mikroorganismer, der får ioner til at lække ud af cellen, som i sidste ende dræber dem. Effektiviteten af denne antimikrobielle aktivitet påvirkes af ionpermeabilitet (hvor hurtigt ioner siver ud af cellen), hastigheden af poredannelse, og størrelsen af de dannede porer.
Resultaterne indikerer, at peptidernes evne til at transformere til et andet molekyle med samme atomsammensætning, men med atomer arrangeret anderledes, letter hurtigere poredannelse. Mens H2 danner større porer end H4, H4 danner porer hurtigere. En blanding af H2/H4, i mellemtiden, danner mellemstore porer med en langsommere hastighed end H4, men tilstedeværelsen af D-aminosyren øger bindingsaffiniteten til lipidmembranen, derved forbedre dens forstyrrende evner.
Tænk på det som et felt med fælder i forskellige størrelser; større fælder tager længere tid at grave, men kan fange flere dyr end en mindre grav. På den anden side, man kan grave mange mindre gruber på samme tid, det tager at grave bare nogle få store. Graver mellemstore pitfælder og tilføjer lokkemad eller lokkemad, der vil tiltrække dyr til gruben, ville være den mest effektive tilgang af alle.
At optrevle den molekylære mekanisme, der letter antimikrobiel aktivitet af disse peptider, kan hjælpe os med bedre at forstå, hvordan frøens forsvarssystem har udviklet sig, og hvordan dette kan bruges til at bekæmpe mikrobielle infektioner af medicinsk betydning. Ifølge Kawano, det ultimative mål er at bruge denne mekanisme til at udvikle bedre antimikrobielle midler, især antimikrobielle midler, der er effektive mod antibiotika-resistente bakterier.
 Varme artikler
Varme artikler
-
 Afsløring af reglerne bag virusstilladskonstruktionForskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University Et team af forskere, herunder Northwestern Engineering-fakult
Afsløring af reglerne bag virusstilladskonstruktionForskere brugte en teknik kaldet SyMAPS til at analysere flere aminosyreændringer i MS2-viruspartiklen. Kredit:Northwestern University Et team af forskere, herunder Northwestern Engineering-fakult -
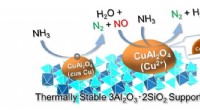 Ny katalysator gør ammoniak til et innovativt rent brændstofCuOx/3A2S producerer selektivt N 2 og H 2 O fra NH 3 gennem en to-trins reaktion. Kredit:Dr. Satoshi Hinokuma At træffe foranstaltninger mod klimaændringer og konvertere til samfund, der bru
Ny katalysator gør ammoniak til et innovativt rent brændstofCuOx/3A2S producerer selektivt N 2 og H 2 O fra NH 3 gennem en to-trins reaktion. Kredit:Dr. Satoshi Hinokuma At træffe foranstaltninger mod klimaændringer og konvertere til samfund, der bru -
 Neutroner tillader analyse af polymergeler usædvanlige egenskaberORNLs Christopher Lam rummer to prøver af polymergeler, som har nyttige anvendelser inden for medicin og forbrugerprodukter. Kredit:ORNL/Genevieve Martin Produkter som kosmetik, klæbemidler, og ma
Neutroner tillader analyse af polymergeler usædvanlige egenskaberORNLs Christopher Lam rummer to prøver af polymergeler, som har nyttige anvendelser inden for medicin og forbrugerprodukter. Kredit:ORNL/Genevieve Martin Produkter som kosmetik, klæbemidler, og ma -
 Forskere forvandler øl til brændstofKredit:CC0 Public Domain Kemikere ved University of Bristol har taget de første skridt mod at lave bæredygtig benzin ved at bruge øl som en nøgleingrediens. Det er almindeligt accepteret, at der
Forskere forvandler øl til brændstofKredit:CC0 Public Domain Kemikere ved University of Bristol har taget de første skridt mod at lave bæredygtig benzin ved at bruge øl som en nøgleingrediens. Det er almindeligt accepteret, at der
- En ny opskrift til effektivt at fjerne iboende defekter fra hårde krystaller
- Team udgiver nye data om historien om Pacific Ring of Fire
- Afvikling af et vigtigt trin i fotosyntetisk iltproduktion
- SDO ser en ny form for magnetisk eksplosion på solen
- Sådan beregner du Azimuth
- Mod ultrahurtig spintronics


