Forståelse af det periodiske system gennem linsen af de flygtige gruppe I metaller
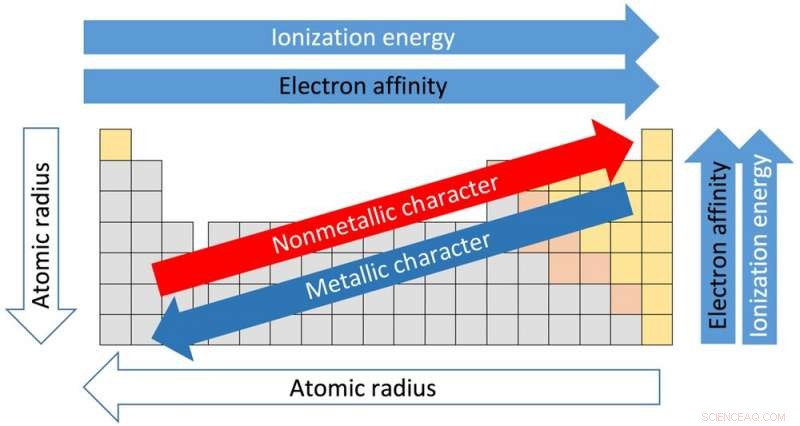
Tendenser i det periodiske system. Kredit:Sandbh/Wikipedia, CC BY-SA
Nyheden brød ud, at en jernbanevogn, fyldt med rent natrium, var lige afsporet og spildte dens indhold. En tv-reporter ringede til mig for at få en forklaring på, hvorfor brandmænd ikke måtte bruge vand på flammerne, der brast fra den ødelagte bil. Mens jeg var i luften, tilsatte jeg noget natrium til en smule vand i en petriskål, og vi observerede den onde reaktion. For yderligere dramatisk effekt, Jeg anbragte også noget kalium i vand og overraskede alle med de eksplosive blålige flammer.
Fordi gruppe I metaller, også kendt som alkalimetaller, er meget reaktive, som natrium fra jernbanevognen eller kalium, de findes ikke i naturen i ren form men kun som salte. Ikke alene er de meget reaktive, de er bløde og skinnende, kan nemt skæres selv med en sløv kniv og er de mest metalliske af alle kendte elementer.
Jeg er en kemiker, der brugte sin karriere på at bygge nye molekyler, nogle gange ved hjælp af gruppe I -elementer. Ved at studere adfærden og tendenserne for gruppe I-elementer, vi kan få et glimt af, hvordan det periodiske system er arrangeret, og hvordan det skal fortolkes.
Det grundlæggende
Arrangementet af det periodiske system og egenskaberne for hvert element i det er baseret på atomnummeret og arrangementet af elektronerne, der kredser om kernen. Atomnummeret beskriver antallet af protoner i grundstoffets kerne. Brints atomnummer er 1, helium er 2, lithium er 3 og så videre.
Hver af de 18 kolonner i tabellen kaldes en gruppe eller en familie. Elementer i samme gruppe deler lignende egenskaber. Og ejendommene kan antages ud fra placeringen i koncernen. Fra toppen af gruppe I til bunden, for eksempel, atomradierne – afstanden fra kernen til de ydre elektroner – øges. Men mængden af energi, der er nødvendig for at rive en ydre elektron af, falder fra toppen til bunden, fordi elektronerne er længere væk fra kernen og ikke holdes så tæt.
Dette er vigtigt, fordi hvordan elementer interagerer og reagerer med hinanden afhænger af deres evne til at tabe og få elektroner til at lave nye forbindelser.
Tabellens vandrette rækker kaldes perioder. Flytning fra venstre side af perioden til højre, atomradius bliver mindre, fordi hvert grundstof har en ekstra proton og en ekstra elektron. Flere protoner betyder, at elektroner trækkes mere tæt ind mod kernen. Af samme grund stiger elektronegativitet - den grad i hvilken et grundstof har tendens til at få elektroner - fra venstre mod højre.
Kraften der kræves for at fjerne den yderste elektron, kendt som ioniseringspotentialet, øges også fra venstre side af bordet, som har elementer med metallisk karakter, til højre side, som er ikke-metaller.
Elektronegativiteten falder fra toppen af søjlen til bunden. Smeltepunktet for grundstofferne i en gruppe falder også fra toppen til bunden af en gruppe.
Anvendelse af det grundlæggende på gruppe I-elementer
Som navnet antyder, Gruppe I-elementer optager den første kolonne i det periodiske system. Hvert element starter en ny periode. Lithium er i toppen af gruppen og efterfølges af natrium, Na; kalium, K; rubidium, Rb; cæsium, Cs og slutter med det radioaktive francium, Fr. Fordi det er meget radioaktivt, stort set ingen kemi udføres med dette element.
Fordi hvert element i denne kolonne har en enkelt ydre elektron i en ny skal, mængderne af disse elementer er store og stiger dramatisk, når de bevæger sig fra toppen til bunden af gruppen.
Af alle gruppe I-elementer, cæsium har de største volumener, fordi den yderste enkelt elektron er løst fastholdt.
På trods af disse tendenser, egenskaberne for elementerne i gruppe I ligner hinanden mere end nogen anden gruppes egenskaber.
Alkalimetaller gennem historien
Bruger kemiske egenskaber som sin guide, Den russiske kemiker Dimitri Mendeleev bestilte korrekt de første gruppe I-elementer i sit periodiske system fra 1869. Det kaldes periodisk, fordi hvert ottende element gentager egenskaberne for det ovenover i tabellen. Efter at have arrangeret alle de dengang kendte elementer, Mendeleev tog det dristige skridt at efterlade tomrum, hvor hans ekstrapolering af kemiske egenskaber viste, at et grundstof burde eksistere. Efterfølgende opdagelse af disse nye elementer viste, at hans forudsigelse var korrekt.
Nogle alkalimetaller har været kendt og brugt længe før Mendeleev skabte det periodiske system. For eksempel, Det Gamle Testamente nævner salt - en kombination af alkalimetalnatrium med chlor - 31 gange. Det Nye Testamente henviser til det 10 gange og kalder natriumcarbonat "neter" og kaliumnitrat for "saltpeter".
Folk har siden antikken vidst, at træaske producerer et kaliumsalt, som, når det kombineres med animalsk fedt, vil give sæbe. Samuel Hopkins opnåede det første amerikanske patent den 31. juli, 1790, for sæbe i henhold til den nye patentlov, som præsident George Washington netop har underskrevet i loven et par måneder tidligere.
Den pyrotekniske industri elsker disse gruppe I-elementer for deres livlige farver og eksplosive natur. Brændende lithium producerer en livlig karmosinrød farve; natrium en gul; kalium lilla; rubidium rød; og cæsiumviolet. Disse farver produceres, når elektroner hopper fra deres hjemmemiljø, der kredser om kernen og vender tilbage igen.
Cæsium atomuret, det mest nøjagtige ur, der nogensinde er udviklet, fungerer ved at måle frekvensen af cæsiumelektroner, der hopper frem og tilbage mellem energitilstande. Ure baseret på elektronspring giver en ekstremt præcis måde at tælle sekunder på.
Andre anvendelser omfatter natriumdamplamper og lithiumbatterier.
I min egen forskning har jeg brugt Gruppe I metaller som værktøjer til at udføre anden kemi. Engang havde jeg brug for absolut tør alkohol, og det tørreste, jeg kunne købe, indeholdt stadig små spor af vand. Den eneste måde at slippe af med den sidste rest vand var ved at behandle den vandholdige alkohol med natrium – en ret dramatisk måde at fjerne vand på.
De alkaliske grundstoffer optager ikke kun den første kolonne i det periodiske system, men de viser også den mest reaktivitet af alle grupper i hele tabellen og har de mest dramatiske tendenser i volumen og ioniseringspotentiale, samtidig med at de bevarer stor lighed indbyrdes.
Denne artikel er genudgivet fra The Conversation under en Creative Commons-licens. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Hvad er resultatet af at tilføje blynitrat til kaliumjodid?Når du blander to stoffer, sker der undertiden en kemisk reaktion, der resulterer i en ændring af farve, tilstand eller temperatur. Blanding af fast blynitrat og fast kaliumiodid resulterer i en æn
Hvad er resultatet af at tilføje blynitrat til kaliumjodid?Når du blander to stoffer, sker der undertiden en kemisk reaktion, der resulterer i en ændring af farve, tilstand eller temperatur. Blanding af fast blynitrat og fast kaliumiodid resulterer i en æn -
 Opdagelse kan føre til mere potent hvidløg, booster smag og dårlig åndeHannah Valentino, venstre, og Pablo Sobrado, ret, udfører forskning, der lægger grunden til en fremtid, hvor købere kan vælge hvidløg ud fra dets styrke og smagsprofil. Kredit:Virginia Tech I århu
Opdagelse kan føre til mere potent hvidløg, booster smag og dårlig åndeHannah Valentino, venstre, og Pablo Sobrado, ret, udfører forskning, der lægger grunden til en fremtid, hvor købere kan vælge hvidløg ud fra dets styrke og smagsprofil. Kredit:Virginia Tech I århu -
 Separationsangst ikke mere:En hurtigere teknik til at rense elementer(fra venstre) Rebecca Abergel, Abel Ricano, og Gauthier Deblonde fra Berkeley Labs Chemical Sciences Division har været banebrydende for en hurtigere metode til at rense grundstoffer. Kredit:Marilyn C
Separationsangst ikke mere:En hurtigere teknik til at rense elementer(fra venstre) Rebecca Abergel, Abel Ricano, og Gauthier Deblonde fra Berkeley Labs Chemical Sciences Division har været banebrydende for en hurtigere metode til at rense grundstoffer. Kredit:Marilyn C -
 Biologisk nedbrydeligt glitter og forureningsædende mikroalger:de nye materialer inspireret af natu…Den reflekterede farve på marmorbæret er forskellig fra celle til celle, giver det et slående udseende. Kredit:Juliano Costa/Wikimedia, licenseret under CC BY-SA 3.0 Irisensen af marmorbær og de
Biologisk nedbrydeligt glitter og forureningsædende mikroalger:de nye materialer inspireret af natu…Den reflekterede farve på marmorbæret er forskellig fra celle til celle, giver det et slående udseende. Kredit:Juliano Costa/Wikimedia, licenseret under CC BY-SA 3.0 Irisensen af marmorbær og de
- Når temperaturerne stiger, flere californiske skove vil brænde
- En advarsel til vinelskere:Klimaændringer roder med din yndlings tippel-timing
- Australien har 2, 000 savnede personer og 500 uidentificerede menneskelige rester – et dedikeret lab…
- Forskere fremstiller polyacrylonitril-afledte kulstoffilm og -fibre ved høj temperatur
- Matematikere foreslår ny måde at bruge neurale netværk til at arbejde med støjende, højdimensio…
- Forskere udvikler en innovativ metode til udfyldning og forsegling af pleurahuler


