Kemisk syntese viser, at antibiotika fra den menneskelige næse virker ved protontranslokation
Kredit:Wiley
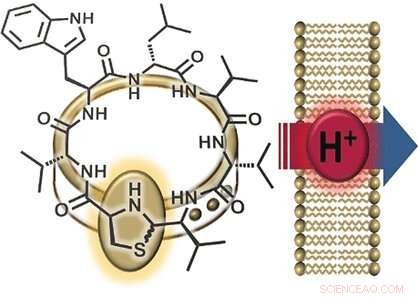
Antibiotika-resistente bakterier er en stigende sundhedstrussel, gør nye antibiotika afgørende. Tyske forskere har for nylig haft et gennembrud:de opdagede lugdunin i den menneskelige næse - en ny slags cyklisk peptid, der kommer fra bakterien Staphylococcus lugdunensis og har stærke antimikrobielle egenskaber mod Stahphylococcus aureus, blandt andre. Forskerne har været i stand til at afklare virkemåden ved at syntetisere varianter. Som de forklarer i journalen Angewandte Chemie , protontransport over bakterielle membraner er involveret.
En interessant del af lugdunins struktur er dens thiazolidingruppe (en ring lavet af ét nitrogenatom, et svovl, og tre carbonatomer), som udgør en del af dens peptidring. Denne femleddede ring ligner en lås, der "pryder" peptidringen. Af denne grund, forskerne navngav deres nye klasse af materialer "fibupeptider, "fra latin fibula , betyder spænde . Efter tidligere at have haft succes med at syntetisere lugdunin, holdet fra universitetet i Tübingen og universitetet i Göttingen (Tyskland) optimerede den syntetiske vej til at lave mange forskellige derivater af dette naturlige stof. Dette gav mulighed for en omfattende undersøgelse af den mekanisme, hvormed lugdunin virker. Forskerne lavede en række derivater, hvor de erstattede hver af aminosyrerne i peptidringen med alanin - en, hvori de slap "smykkelåsen, " og et fibupeptid med en struktur, der er spejlbilledet af lugdunin. De brugte derefter disse derivater til at udføre aktivitetstests.
Holdet, bestående af kemikere, biokemikere, og mikrobiologer, opdagede, at den cykliske struktur af peptidet, thiazolidinlåsen, " og to aminosyrer (tryptophan og leucin), er kritiske for stoffets antibiotiske aktivitet. Ud over, peptidringen skal altid være lavet af skiftevis D- og L-aminosyrer. Imidlertid, der var ingen forskel i aktiviteten af det oprindelige molekyle eller dets spejlbillede. "Dette indikerer en mangel på stereospecifik receptor-ligand interaktion, " siger Nadine Schilling, et medlem af teamet ledet af Stephanie Grond, "i stedet, det taler for interaktion med et lille molekyle eller ion."
En yderligere observation var, at aktive lugdunin-derivater nedbryder det elektriske potentiale (forskellen i spænding mellem det indre og det ydre) af bakterielle cellemembraner, derved dræber bakterierne. Inkorporering af et ekstra tryptofan-molekyle intensiverede interaktionen med membranen og styrkede den antibakterielle virkning. Grund siger:"Disse resultater tyder på iontransport over bakteriemembranen." For at undersøge denne funktion nærmere, forskerne producerede syntetiske vesikler med en pH-gradient i forhold til den omgivende opløsning. Tilsætning af aktive fibupeptider førte til hurtig pH-udligning, uden ødelæggelse af membranen eller dannelse af porer. "Mekanismen består klart af translokation af protoner over membranen, " siger Grond. "Vi mangler stadig at afgøre, om lugdunin fungerer som en mobil transportør eller en protonkanal."
 Varme artikler
Varme artikler
-
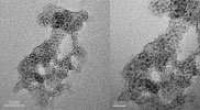 Porøs silica beskytter nikkelkatalysatorTransmissionselektronmikroskopi billeder af (venstre, center) nikkel-silica-katalysator og (til højre) en kommerciel katalysator. Kredit:Genoptrykt fra Ref. 1, Copyright 2018, med tilladelse fra Elsev
Porøs silica beskytter nikkelkatalysatorTransmissionselektronmikroskopi billeder af (venstre, center) nikkel-silica-katalysator og (til højre) en kommerciel katalysator. Kredit:Genoptrykt fra Ref. 1, Copyright 2018, med tilladelse fra Elsev -
 Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d
Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d -
 Nyt materiale med stærk virkning mod svampe og tumorer udvikletForskere ved Functional Materials Development Center - et FAPESP CEPID i São Carlos - skaber komposit med 32 gange større svampedræbende egenskaber end sølv ved at udstråle en metallisk wolfram med fe
Nyt materiale med stærk virkning mod svampe og tumorer udvikletForskere ved Functional Materials Development Center - et FAPESP CEPID i São Carlos - skaber komposit med 32 gange større svampedræbende egenskaber end sølv ved at udstråle en metallisk wolfram med fe -
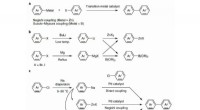 Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin
Kemikere viser, at natrium sikkert kan bruges til krydskoblingsreaktionerFremstilling af organometalliske forbindelser og de efterfølgende krydskoblingsreaktioner. en, Overgangsmetal-katalyserede krydskoblingsreaktioner. b, Almindelige metoder til fremstilling af organozin
- Fysikere udvikler model, der beskriver længdevækst i biologiske systemer
- Find årsagen til et fatalt problem i raketmotorforbrændere
- Japan vedtager anti-plastlov, men uden sanktioner for forurenere
- Browns studentersatellit, der skal indsættes fra ISS i kredsløb
- Tænder det op:En ny giftfri, billig, og stabilt blåt fotoluminescerende materiale
- Comet U1 NEOWISE—en mulig kikkertkomet?


