Nye kemiske værktøjer til at modificere og studere biomolekyler
En illustration af den kemiske reaktion udviklet i undersøgelsen. Kredit:J. Waser/B. Fierz (EPFL)
Forståelse af strukturen og metabolismen af celler og levende organismer er afgørende for udviklingen af nye lægemidler og diagnostik. Tilgængeligheden af kemiske værktøjer, der gør det muligt for forskere at redigere biomolekyler, ligesom proteiner, med opløsning på atomniveau har i høj grad bidraget til den kemiske biologis fremskridt.
Proteiner er makromolekyler konstrueret af et sæt af tyve kemisk forskellige aminosyrer. En vigtig tilgang til at modificere proteiner er at reagere med svovlatomet i aminosyren cystein. Imidlertid, nuværende metoder er stadig problematiske med hensyn til effektivitet, selektivitet, og slutproduktets stabilitet ("adduktet").
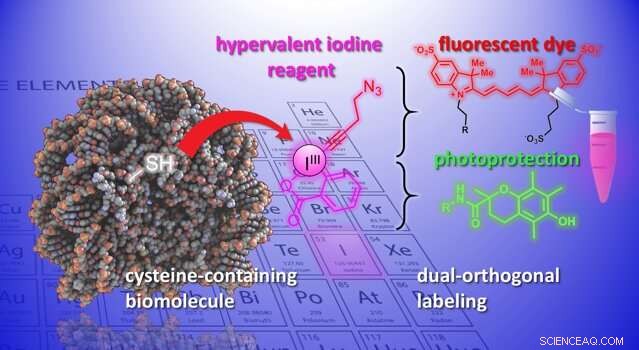
Nu, laboratorierne af Jérôme Waser og Beat Fierz ved EPFL's Institute of Chemical Sciences and Engineering har udviklet en ny metode til ændring af cystein på peptider og proteiner. Metoden anvender en gruppe stærkt reaktive organiske molekyler, ethynylbenziodoxoloner (EBX'er). Det, der gør EBX'er meget reaktive, er, at de indeholder et jodatom bundet til tre substituentgrupper. Denne ikke-naturlige situation fører til høj reaktivitet i disse såkaldte "hypervalent jod"-reagenser.
For første gang, forskerne var i stand til at generere et simpelt biomolekyle-EBX-addukt, mens de holdt deres reaktive jodgruppe i det endelige molekyle. Reaktionen kan let udføres af en ikke-ekspert under fysiologiske standardbetingelser.
Slutproduktet er protein-hypervalente jodreagens-kimærer, der kan fungere som dobbelte fastgørelsespunkter for to nye kemiske grupper, åbner nye muligheder for undersøgelse af biologiske processer.
"En ny funktionalitet kan introduceres via 'klikkemi, 'en veletableret reaktion i kemisk biologi, " siger Waser. "Ved at bruge en palladiumkatalysator, en anden selektiv modifikation kan opnås ved det reaktive jodatom - hvad vi ville kalde en 'biorthogonal' funktionalitet, da den ikke findes i naturen. "At indføre sådanne eksotiske reaktive grupper i biomolekyler er i øjeblikket et af de vigtigste værktøjer inden for kemisk biologi, da det tillader undersøgelse af biologiske processer uden at forstyrre dem.
Forskerne demonstrerede metodens potentiale ved at indføre et mangfoldigt sæt kemiske grupper i biomolekyler. For eksempel, forskerne brugte det dobbelte håndtag til at vedhæfte et fluorescerende farvestof og en fotobeskyttelsesgruppe til et neuropeptid samtidigt. Ved at kombinere dem forbedrer farvestoffets fotostabilitet, og muliggør høj opløsning, enkelt-molekyle billeddannelse af molekylære interaktioner.
Ud over peptider, de modificerede yderligere små proteiner, og endda store protein-DNA-komplekser, såkaldte nukleosomer. Når nukleosomer organiserer genomet, mærkning af dem med fluorescerende farvestoffer kan hjælpe med at spore dem til at tyde, hvordan naturen regulerer genekspression.
"Det, vi udviklede her, er en ny metode til at ændre proteiner baseret på grundlæggende undersøgelser af kemisk reaktivitet, " siger Fierz. "Vi har allerede brugt det til at modificere histoner, og udførte fluorescensforsøg på levende celler. Med disse eksempler, vi har lagt grundlaget for en bedre forståelse af biologiske processer. "
Undersøgelsen er offentliggjort i Chem i dag.
 Varme artikler
Varme artikler
-
 Hvordan man forhindrer katodisk korrosion af metalelektroder i elektroorganisk synteseGrafisk abstrakt. Kredit:DOI:10.1021/acs.chemrev.1c00148 Bæredygtighed er et vigtigt emne i erhvervslivet i disse dage. Mange virksomheder erkender behovet for at finde de bedst mulige klimaneutra
Hvordan man forhindrer katodisk korrosion af metalelektroder i elektroorganisk synteseGrafisk abstrakt. Kredit:DOI:10.1021/acs.chemrev.1c00148 Bæredygtighed er et vigtigt emne i erhvervslivet i disse dage. Mange virksomheder erkender behovet for at finde de bedst mulige klimaneutra -
 Undersøgelse viser, hvordan små rum kunne have været forud for cellerForskere brugte Argonnes Advanced Photon Source til at studere membranløse rum kaldet komplekse coacervater, da de gennemgik våd-tør-cykler, en undersøgelse, der kaster lys over den prebiotiske jord o
Undersøgelse viser, hvordan små rum kunne have været forud for cellerForskere brugte Argonnes Advanced Photon Source til at studere membranløse rum kaldet komplekse coacervater, da de gennemgik våd-tør-cykler, en undersøgelse, der kaster lys over den prebiotiske jord o -
 Hvad er de 5 fremtrædende egenskaber ved vand?Vand synes at være den eneste vigtigste miljøfunktion, der tillader eksistens og opretholdelse af liv. Der er organismer, der findes uden sollys eller ilt, men der er endnu ikke fundet nogen, der eksi
Hvad er de 5 fremtrædende egenskaber ved vand?Vand synes at være den eneste vigtigste miljøfunktion, der tillader eksistens og opretholdelse af liv. Der er organismer, der findes uden sollys eller ilt, men der er endnu ikke fundet nogen, der eksi -
 Undersøgelse viser, at zinks oxidationstilstand kan laves +3, fundamentalt ændre grundstoffernes k…Kredit:Unsplash/CC0 Public Domain Zink har traditionelt en valens på to, hvilket betyder, at to elektroner deltager i grundstoffets kemiske reaktion. Et nyt papir af Virginia Commonwealth Universi
Undersøgelse viser, at zinks oxidationstilstand kan laves +3, fundamentalt ændre grundstoffernes k…Kredit:Unsplash/CC0 Public Domain Zink har traditionelt en valens på to, hvilket betyder, at to elektroner deltager i grundstoffets kemiske reaktion. Et nyt papir af Virginia Commonwealth Universi
- Undersøgelse af amerikansk tunfiskeri udforsker sammenhængen mellem klimaændringer, bæredygtig f…
- Lovende ny legering til resistiv koblingshukommelse
- Hvem har kontrol? Forsker undersøger, hvorfor det er så svært at koble fra sociale medier
- Hvad sker der med en eksoterm reaktion, hvis temperaturen hæves?
- Nye satellitdatateknikker afslører kystniveau ved havniveau
- Hvordan man laver en ren prøve af kalium


