Hvad sker der, når du eksploderer en kemisk binding?
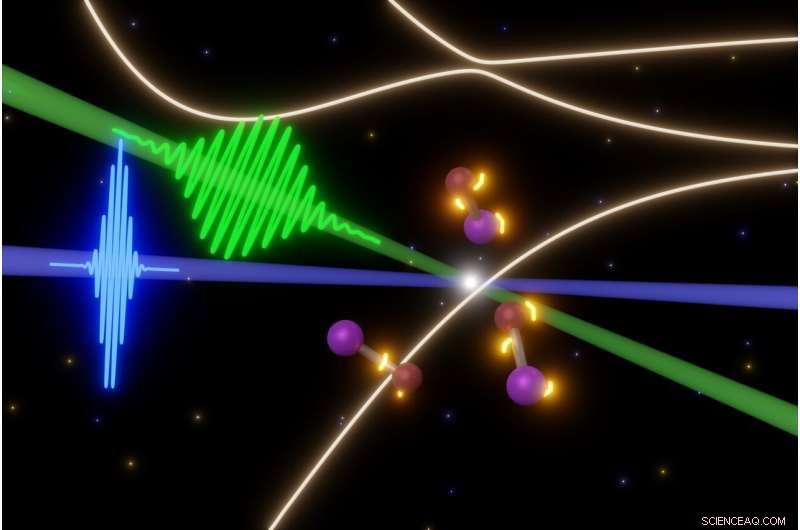
UC Berkeley-forskere undersøger de flygtige trin i hurtige fotokemiske reaktioner med nogle af de korteste laserimpulser, der er mulige i dag. I dette tilfælde, en femtosekundspuls af synligt lys (grønt) udløser opbrydning af jodmonobromidmolekyler (i midten), mens attosecond XUV laserimpulser (blå) tager snapshots af molekylerne. Dette giver dem mulighed for at lave en film om udviklingen af elektroniske tilstande (gult lys omkring molekyler), før molekylerne blæser fra hinanden. Kredit:Yuki Kobayashi, UC Berkeley
På lyse sommerdage, sollyset overalt omkring os bryder dårligt ved at bryde bånd. Kemiske bindinger.
Ultraviolet lys knuser forbindelserne mellem atomer i vores hudcellers DNA, potentielt kan forårsage kræft. UV -lys bryder også iltbindinger, til sidst at skabe ozon, og spalter brint fra andre molekyler for at efterlade frie radikaler, der kan beskadige væv.
University of California, Berkeley, kemikere, der bruger nogle af de korteste laserimpulser til rådighed - en kvintilliontedel af et sekund - har nu været i stand til at løse den trinvise proces, der fører til eksplosionen af en kemisk binding, i det væsentlige lave en film af begivenheden. De kan følge elektroner, der ubeslutsomt hopper rundt i forskellige tilstande i molekylet, før bindingen bryder, og atomerne går hver til sit.
Teknikken, rapporteret i sidste uge i bladet Videnskab , vil hjælpe kemikere med at forstå og potentielt manipulere kemiske reaktioner stimuleret af lys, såkaldte fotokemiske reaktioner. Kemikere og biologer, i særdeleshed, er interesseret i at forstå, hvordan store molekyler formår at absorbere lysenergi uden at bryde nogen bindinger, som det sker, når molekyler i øjet absorberer lys, giver os visioner, eller molekyler i planter absorberer lys til fotosyntese.
"Tænk på et molekyle, rhodopsin, i øjet, " sagde førsteforfatter Yuki Kobayashi, en UC Berkeley doktorand. "Når lys rammer nethinden, rhodopsin absorberer det synlige lys, og vi kan se ting, fordi rhodopsins bindings struktur ændrer sig."
Faktisk, når lysenergien absorberes, en binding i rhodopsin twists, i stedet for pauser, udløser andre reaktioner, der resulterer i opfattelsen af lys. Teknikken Kobayashi og hans UC Berkeley-kolleger, professorerne Stephen Leone og Daniel Neumark, udviklet kunne bruges til at studere i detaljer, hvordan denne lysabsorption fører til vridning, efter at molekylet passerer gennem en exciteret tilstand kaldet en undgået krydsning eller konisk skæring.
For at forhindre brydning af en binding i DNA, "du ønsker at omdirigere energien fra dissociation til bare at være vibrationelt varm. For rhodopsin, du vil omdirigere energien fra vibrerende til en cis-trans-isomerisering, et twist, "Sagde Kobayashi." Disse omdirigeringer af kemiske reaktioner sker allestedsnærværende omkring os, men vi har ikke set det faktiske øjeblik af dem før."

Yuki Kobayashi laver justeringer af et eksperiment i kælderen i Hildebrand Hall. Han og forskere i Stephen Leones og Daniel Neumarks laboratorier målretter mod molekyler i et vakuumkammer med både femtosekund- og attosekundlasere for at finde ud af, hvordan molekyler absorberer lys. Kredit:UC Berkeley foto udlånt af Robert Sanders
Hurtige laserimpulser
Attosekundlasere - et attosekund er en milliarddel af en milliarddel af et sekund - har eksisteret i omkring et årti og bruges af forskere til at undersøge meget hurtige reaktioner. Da de fleste kemiske reaktioner sker hurtigt, disse hurtigpulslasere er nøglen til at "se", hvordan elektronerne, der danner den kemiske binding, opfører sig, når bindingen brydes og/eller reformeres.
Leone, professor i kemi og fysik, er en eksperimentalist, der også bruger teoretiske værktøjer og er en pioner i at bruge attosecond-lasere til at sondere kemiske reaktioner. Han har seks af disse røntgenstråler og ekstrem ultraviolet (tilsammen, XUV) lasere i hans UC Berkeley laboratorium.
At arbejde med et af de enkleste molekyler, jodmonobromid (IBr) – som er ét jodatom forbundet med ét bromatom – UC Berkeley-holdet ramte molekylerne med en 8 femtosekunders puls af synligt lys for at excitere en af deres yderste elektroner, derefter sonderet dem med attosecond laserimpulser.
Pulsering af attosecond XUV-laseren med tidsindstillede intervaller på 1,5 femtosekund (et femtosekund er 1, 000 attosekunder), meget som at bruge et stroboskoplys, forskerne kunne opdage de trin, der førte til opdelingen af molekylerne. Den højenergiske XUV-laser var i stand til at udforske de ophidsede energitilstande i forhold til molekylets indre elektroner, som normalt ikke deltager i kemiske reaktioner.
"Du laver en slags film af elektronens veje, når den nærmer sig krydset, og sandsynligheden for, at den går ad en vej eller langs en anden, " sagde Leone. "Disse værktøjer, vi udvikler, giver dig mulighed for at se på faste stoffer, gasser og væsker, men du har brug for de kortere tidsskalaer (leveret af en attosecond laser). Ellers, du ser kun begyndelsen og slutningen, og du ved ikke, hvad der ellers skete i mellem."
Forsøget viste tydeligt, at de ydre elektroner af Ibr, engang begejstret, pludselig se en række stater eller steder, de kunne være, og udforske mange af dem, før du beslutter dig for, hvilken vej du skal tage. I dette simple molekyle, imidlertid, alle veje fører til, at elektronen sætter sig på enten jod eller brom, og de to atomer flyver fra hinanden.
I større molekyler, som teamet håber snart at udforske, ophidsede elektroner ville have flere valgmuligheder, nogle hvor energien går i et twist, ligesom med rhodopsin, eller til molekylær vibration uden at molekylerne går i stykker.
"I biologi, det viser sig, at evolutionen har udvalgt ting, der er ekstremt effektive til at absorbere energien og ikke bryde et bånd, " sagde Leone. "Når noget går galt i din kemi, er når du ser sygdomme dukke op."
 Varme artikler
Varme artikler
-
 Kobberkatalysator giver højeffektiv CO2-til-brændstofkonverteringSkematisk af en ny katalysator lavet af kobbernanopartikler, der omdanner kuldioxid til multicarbonprodukter (ethylen, ethanol, og propanol). Øverst til venstre er transmissionselektronmikroskopbilled
Kobberkatalysator giver højeffektiv CO2-til-brændstofkonverteringSkematisk af en ny katalysator lavet af kobbernanopartikler, der omdanner kuldioxid til multicarbonprodukter (ethylen, ethanol, og propanol). Øverst til venstre er transmissionselektronmikroskopbilled -
 Verdens reneste vanddråbeDen ultraklanske istap (til venstre) og dråben, efter smeltning. Kredit:TU Wien I naturen, der er ikke noget, der hedder en virkelig ren overflade. Kontakt med normal luft er tilstrækkelig til at
Verdens reneste vanddråbeDen ultraklanske istap (til venstre) og dråben, efter smeltning. Kredit:TU Wien I naturen, der er ikke noget, der hedder en virkelig ren overflade. Kontakt med normal luft er tilstrækkelig til at -
 Unik grænseflade og uventet adfærd hjælper med at forklare, hvordan tungmetaller virkerForskere identificerede tre forskellige typer vandmolekyler, der omgiver en tung, anionisk metalchloridkompleks (nederst) ved brug af spektroskopi (øverst) ved en luft/vand-grænseflade. Hver type vand
Unik grænseflade og uventet adfærd hjælper med at forklare, hvordan tungmetaller virkerForskere identificerede tre forskellige typer vandmolekyler, der omgiver en tung, anionisk metalchloridkompleks (nederst) ved brug af spektroskopi (øverst) ved en luft/vand-grænseflade. Hver type vand -
 Ændringer i bakteriecellevæggen producerer flere fedtmolekylerForskere undersøgte de systemer, der kontrollerer lipidproduktionen i bakterien Rhodobacter sphaeroides for at øge lipidproduktionen til industriel brug. Kredit:DOEs Environmental Molecular Sciences L
Ændringer i bakteriecellevæggen producerer flere fedtmolekylerForskere undersøgte de systemer, der kontrollerer lipidproduktionen i bakterien Rhodobacter sphaeroides for at øge lipidproduktionen til industriel brug. Kredit:DOEs Environmental Molecular Sciences L
- Udkast til FN -rapport advarer om stigende hav, stormfloder, smeltende permafrost
- Mellemmasse sort hul kaster stjerne hen over Mælkevejen
- Børn forstår plante-dyrs indbyrdes afhængighed i en alder af otte
- Skove har højere termisk bufferevne end ikke-skove
- Implantering af diamanter med fejl tilbyder nøgleteknologi til kvantekommunikation
- Løsning af jordskælvsproblem med geotermisk energi


