Mikrofluidik:2-D fingeraftryk af heterogene proteiner i opløsning
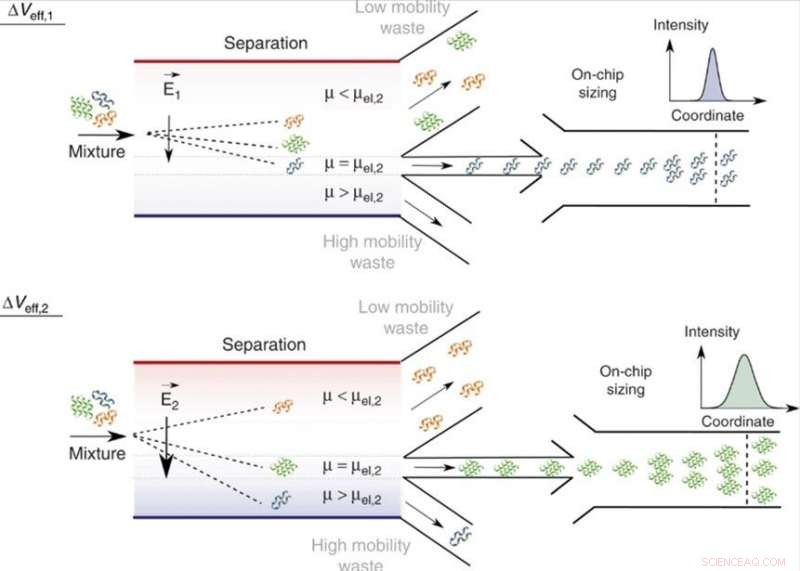
On-chip separation og analyse af blandinger i væskefase. Ved at justere den effektive spænding, Δveff, molekyler med en specifik elektroforetisk mobilitet, μ = μel, og dermed et specifikt forhold mellem ladning og hydrodynamisk radius, qRh, kan dirigeres til analyseområdet med dem for mindre (μ < μel) og større (μ > μel) mobilitetsværdier rettet til affaldsindsamlingskanalerne. Da den påførte spænding kan varieres, kun en enkelt analyseenhed er påkrævet, og bredden af adskillelseskammeret kan holdes begrænset, giver enheden mulighed for at bevare en høj spændingseffektivitet og en hurtig behandlingshastighed. På analyseområdet, fraktionerne dimensioneres gennem mikrofluidisk diffusionsstørrelse (MDS) ved at overvåge deres spatiotemporale bevægelse under laminære strømningsbetingelser. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3
Mikrofluidiske systemer bruges i molekylærbiologi, biokemi og bioteknologi til hurtigt at analysere heterogene biomolekylære blandinger med høje genvindingshastigheder og små prøvevolumener. Imidlertid, det er udfordrende at kombinere forberedende og analytiske processer inden for en enkelt enhed til hurtig integreret analyse. I en nylig undersøgelse offentliggjort på Mikrosystemer og nanoteknik , Kadi L. Saar og medarbejdere ved de tværfaglige afdelinger for kemi, fysik, og Fluidic Analytics Limited i Cambridge, U.K., har udviklet en chip, der kombinerer de to trin forberedelse og analyse.
I første omgang, de brugte spænding til at adskille proteinmolekyler i en binær blanding af lige store biomolekyler, der ikke kunne skelnes via konventionel størrelses- eller opløsningsteknikker. Derefter, forskerholdet brugte den nye enhed til at opnå et 2-D fingeraftryk af en heterogen proteinblanding. Resultaterne vil åbne nye muligheder for at erhverve hurtige multiparameterdata om biomolekylære systemer på en kort tidsskala.
Mikrofluidiske teknikker er attraktive at analysere biologiske prøver på grund af meget lave prøvekrav og en høj genvindingshastighed. Platformene kan give uovertruffen analysehastighed på niveauet af individuelle driftsenheder eller give flere enheder direkte kombineret arbejdsgang, uden prøveoverførsel mellem enhederne. Sådanne overførsler sker gennem konnektorer eller rør og introducerer dispersion til prøven, påvirker systemets ydeevne. Den heri foreslåede arbejdsgang kan adskille heterogene blandinger for at bestemme komponenterne af interesse og reducere kompleksiteten til yderligere behandling af blandingen til dens oprensning.
Forskere havde tidligere introduceret en række kontinuerlige flow-baserede molekylære separationsstrategier på mikron skala, inklusive fristrømselektroforese, dielektroforese, magnetoforese og akustoforetisk adskillelse. Detektionsstrategier såsom laser- eller LED-induceret fluorescens (LIF), kemiluminescens eller elektrokemiske tilgange kan forankres parallelt i sådanne mikrofluidadskillelsesplatforme. Analytisk information om de adskilte forbindelser kan opnås med offline strategier såsom massespektroskopi eller SDS-PAGE, men teknikkerne kan begrænse behandlingshastigheden i en enkelt enhed, forårsage prøvetab eller kontaminering.
Saar et al. udviklede derfor fuldt integreret separation og kvantitativ karakterisering af heterogene biomolekylære prøver i en enkelt mikrofluidisk enhed for at overvinde de eksisterende grænser ved direkte at koble on-chip separation til on-chip analyse og molekylær størrelse. Designfunktionen tillod analyse af en specifik fraktion ved at justere den anvendte feltstyrke. De designede enheden til at identificere adskilte fraktioner svarende til SEC-MALS (størrelsesudelukkelseskromatografi med multi-vinkel lysspredning) eller LC (chip)-MS ((på-chip)-væskekromatografi-massespektrometri) metoder.
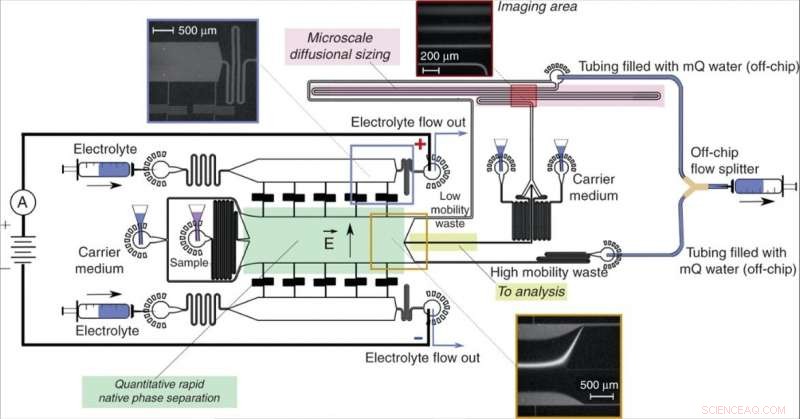
Enhedens design og drift. En fristrømselektroforeseenhed (grøn), tillader hurtig adskillelse af analytmolekyler i deres native fase og giver kvantitativ information om separationsprocessen, rettet fraktioner af prøven (gul) til en nedstrøms analyseproces, der involverer mikrofluidisk diffusionsstørrelse (MDS; pink). Prøven blev karakteriseret ved at overvåge en enkelt billedramme (øverst til højre) for samtidig at udtrække størrelserne og ladningerne af de adskilte fraktioner. Enheden blev betjent ved at påføre et undertryk ved dens udløb med en Y-formet off-chip flow splitter, der holdt løsningerne fra kanalerne "lavt mobilitet" og "affald med høj mobilitet" adskilt for at undgå delvis kortslutning af enheden. Det elektriske potentiale blev påført fra elektrolytopløsningens udløb under anvendelse af en strømmende elektrolytopløsning som beskrevet tidligere13. Strømmen af elektrolytopløsningen, som inkluderede et fluorescerende sporstof til dets visualisering, blev valgt således, at elektrolytten ville nå sit udløb i stedet for at blive trukket ind i adskillelseskammeret uden at nå det (øverst til venstre indsat), alligevel ville det lække ind i kammeret med en kontrolleret afstand, efterlader tilstrækkelig plads til at afbøje prøvestrålen (nederst indsat). Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3
Enheden havde den yderligere fordel at udføre hele processen fuldt indgroet til elektroforetisk adskillelse i fri opløsning, giver forskere mulighed for at opnå et kvantitativt kort på få minutter - meget hurtigere end konventionelle teknikker. Blandingen var upåvirket af det bærende medium, og forskerne kunne studere både svage og ikke-kovalente molekylære interaktioner.
Saar et al. designet enheden ved hjælp af en native fase kvantitativ elektroforeseenhed forbundet med en mikrofluidisk diffusionsenhedsstørrelse (MDS) enhed. Den kombinerede platform tillod komponenter med specifik elektroforetisk mobilitet (µ e1 ) til on-chip downstream analyse, som funktion af den påførte elektriske feltstyrke. De designede tre kanaler nedstrøms for elektroforeseenheden for at holde elektrolyseprodukter væk fra chippen uden at komme ind i enheden. De minimerede antallet af individuelle enheder, der drev flowet i enheden, koblet til stabil enhedsdrift til kvantitativ prøvekarakterisering. Forskerne holdt elektrolyttens udgange adskilt fra den kombinerede enhed for at påføre elektrisk potentiale på tværs af enheden uden at generere en elektrisk kortslutning, og at tillade effektiv fjernelse af ethvert elektrolyseprodukt uden akkumulering for at forhindre tryksvingninger.
Forskerholdet anvendte det elektriske potentiale på metalliske konnektorer til at generere en metal- og væskegrænseflade uden for chippen i overensstemmelse med enhedsprototypen designet af det samme hold. I dette arbejde, Saar et al. designet en Y-formet flowsplitter og holdt vandløbene adskilt, indtil de nåede splitteren for at forhindre delvis kortslutning. De beregnede strømningshastigheden af elektrolytten ind i enheden for at have en effekt på enhedens ydeevne.
(a) Spændingen påført over elektroforesekammeret blev justeret i lineære trin for at dirigere specifikke fraktioner til analyse. (b) Fraktionerne blev derefter dimensioneret ved at afbilde diffusionsstørrelsesenheden bestående af fire kanaler, hvori omfanget af diffusionen af analytmolekylerne ind i deres omgivende bærerbuffer blev overvåget. (c) Den gennemsnitlige størrelse af analytmolekylerne i hver af fraktionerne blev fundet ved at tilpasse de observerede fluorescerende profiler for forskellige hydrodynamiske radier (Rh) og minimere den mindste gennemsnitlige kvadratiske fejl mellem tilpasningen (rød stiplet linje) og dataene (blå) kontinuerlig linje). (d) Fluorescensintensiteten i analyseområdet varierede afhængigt af koncentrationen af analytterne i hver af fraktionerne (øverst) og størrelsen af komponenterne i en binær blanding af lysozym og bovint serumalbumin viste sig at være Rh = 1,9 nm og Rh = 3,6 nm (nederst). (e) Denne binære blanding kunne ikke karakteriseres ved hjælp af limningsteknikker, der ikke involverer præfraktioneringstrin, såsom dynamisk lysspredning (DLS; lyseblå stiplet linje). Dens dimensionering var mulig ved hjælp af den enhed, der er beskrevet i dette arbejde (mørkeblå kontinuerlig linje). Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3 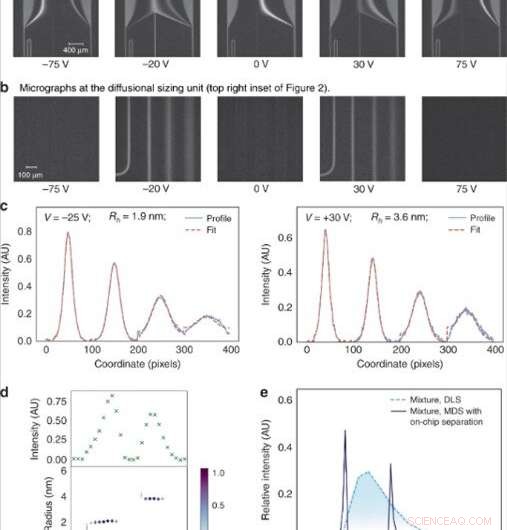
De afbildede dysen, hvor prøven mødte bæremediet, som et referencepunkt for partikelbevægelse. Forskerne justerede diffusionsdimensioneringskanalen eller strømningshastigheden for nøjagtigt at dimensionere analytmolekylerne, størrelsesordener større eller mindre i størrelse. Siden de konstruerede mikrofluidikplatformen ved hjælp af poly(dimethylsiloxane) (PDMS), forskerne eliminerede enhver autofluorescens i opsætningen, før de analyserede billeddataene.
De brugte derefter enheden til at analysere en binær blanding af prøveproteiner; bovint serumalbumin og humant lysozym. For at bevare proteinmolekylernes native tilstande afbildede de de mærkefri prøver med et hjemmebygget UV-bølgelængdebaseret mikroskop og kvantificerede prøvens iboende fluorescens. Saar et al. bekræftede evnen til at adskille blandingen i dens komponenter ved først at anvende et sæt spændinger for at registrere de fluorescerende profiler. De registrerede derefter de elektroforetiske mobiliteter af proteinerne (µ e1 ) kombineret med strømningshastigheden i enheden for at karakterisere de fleste proteiner og deres komplekser. Forskerne ændrede flowhastigheden eller den påførte spænding for at analysere biomolekyler med forskellige biofysiske parametre.
Brug af platformen, de karakteriserede hurtigt blandinger af nanoskala molekyler, hvor individuelle analytter viste lignende størrelser, men forskellige elektroforetiske egenskaber. Baseret på det resulterende histogram, forskerholdet bekræftede tilstedeværelsen af to forskellige prøver. Forholdsvis, i en off-chip konventionel separationstilgang, sidstnævnte trin krævede fraktionering ved prøveoverførsel fra et analyseværktøj til et andet via indbyrdes forbundne rør, begrænser enhedens ydeevne. Den samlede proteinkoncentration i undersøgelsen var tilnærmet 100 µM, og forskerne opdagede nøjagtigt følsomhedsgrænsen til cirka 100 nM, i forhold til den iboende fluorescens af proteinfraktioner. For optisk ikke-aktive forbindelser, Saar et al. foreslå en alternativ detektions- og karakteriseringsstrategi såsom tør masseføling.
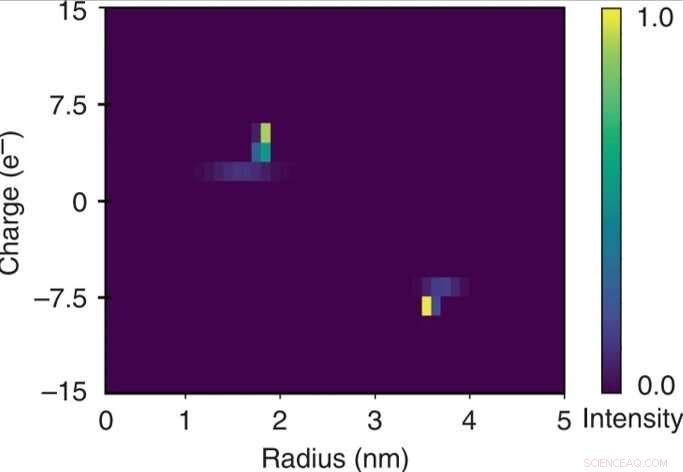
Hurtig todimensionel karakterisering af en blanding af bovint serumalbumin og humant lysozym. Den kvantitative karakter af den elektroforetiske separationsenhed tillod det påførte potentiale at blive relateret til den elektroforetiske mobilitet μel af hver af fraktionerne. Disse data blev brugt i kombination med de ekstraherede hydrodynamiske radier (Rh) til at estimere de effektive ladninger (q) af molekylerne i hver af fraktionerne og til at konstruere et todimensionelt q vs Rh-kort af blandingen over et par minutters tidsskala ved at kun overvåger enheden ved en enkelt billedramme. Kredit:Microsystems &Nanoengineering, doi:10.1038/s41378-019-0072-3
Saar et al. brugt strategien til at opnå todimensionelle (2-D) karakteristiske kort over proteinblandingen som et proof-of-concept. De udtog kvantitativ information fra separationstrinnet og relaterede de anvendte potentialer til artens elektroforetiske mobiliteter for at estimere enhedens effektivitet. De registrerede strømmen, der flyder i systemet under normal drift, og når separationskammeret blev kortsluttet for at estimere den samlede elektriske modstand af enheden og elektroderne.
Forskerne beregnede den elektroforetiske mobilitet som bevægelsen af en partikel i et elektrisk felt for hver af fraktionerne. Baseret på de eksperimentelle data, det konstruerede 2-D karakteristiske kort inkluderede den effektive ladning (q) og den hydrodynamiske radius (Rh) af blandingen. De resulterende elementære ladningsenheder af de specifikke proteiner stemte overens med estimerede værdier andre steder. De opnåede det fulde todimensionelle kort ved kun at overvåge en enkelt billedramme til hurtig analyse i opløsning.
Den analytiske tid for mikrofluidikanordningen fra adskillelse til diffusionsdimensionering og billeddannelse var cirka 14 sekunder. Forskerne konstruerede det eksperimentelle 2D-kort ved at bruge kun 3 µL prøve over syv minutter i alt, størrelsesordener hurtigere end tidsskalaen til at udføre konventionelle 2-D proteingeler. Forskerholdet gennemførte en bred vifte af biomolekylære interaktioner, i løsning, direkte under indfødte forhold, som tidligere var udfordrende at udføre i laboratoriet.
På denne måde Kadi L. Saar og kolleger udviklede en mikrofluidisk enhed, der kombinerer on-chip-separation med direkte on-chip-analyse for at erstatte de eksisterende konventionelle mikroskalametoder. Ved at bruge enheden, de analyserede hurtigt en binær blanding af proteiner, der ikke kunne identificeres som individuelle komponenter via eksisterende løsningsstørrelsesmetoder. De konstruerede et 2-D karakteristisk kort over den heterogene blanding på en hurtig tidsskala for at åbne muligheden for proteinkarakterisering i opløsning med en hidtil uset tidsopløsning sammenlignet med eksisterende biofysiske teknikker.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 Brug af sukkermolekyler til at få bomuldsmateriale til at glødeDigitalkamerabillede fra in vitro bomuldsmodel efter inkorporering af eksogene molekyler med nye funktionaliteter. Kredit:Filipe Natalio (Phys.org) – Et team af forskere fra Tyskland, Israel og Øs
Brug af sukkermolekyler til at få bomuldsmateriale til at glødeDigitalkamerabillede fra in vitro bomuldsmodel efter inkorporering af eksogene molekyler med nye funktionaliteter. Kredit:Filipe Natalio (Phys.org) – Et team af forskere fra Tyskland, Israel og Øs -
 Forskere udvikler nyt kombinatorisk proteinbibliotekKombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu,
Forskere udvikler nyt kombinatorisk proteinbibliotekKombinatoriske biblioteker er en nøglekomponent i kemikerens værktøjssæt til ligandscreening. Dynamiske kombinatoriske biblioteker tilføjer en ny dimension ved at sammenkæde syntese og screening. Nu, -
 Ny indsigt i dannelsen af bulk metalliske glasKredit:Unsplash/CC0 Public Domain Med evnen til at producere metallisk glas i bulkmængder, den særlige mekaniske opførsel af disse materialer har åbnet op for nye anvendelsesmuligheder. Imidlertid
Ny indsigt i dannelsen af bulk metalliske glasKredit:Unsplash/CC0 Public Domain Med evnen til at producere metallisk glas i bulkmængder, den særlige mekaniske opførsel af disse materialer har åbnet op for nye anvendelsesmuligheder. Imidlertid -
 Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
- Et spring fremad med hensyn til at estimere afgrødernes vandforbrug
- Efter årtier i udvikling, Hondas jetfly udvikler sig stille og roligt
- Forskere finder, at fejlkilden til en havisens model varierer med årstiden
- Beskadigende grafen for at skabe et båndgab
- Bøjning af reglerne:En revolutionerende ny måde, hvorpå metaller kan formes
- Camouflage lavet af kvantemateriale kan skjule dig fra infrarøde kameraer


