Undersøgelse afslører metodebegrænsninger til bestemmelse af proteinstruktur
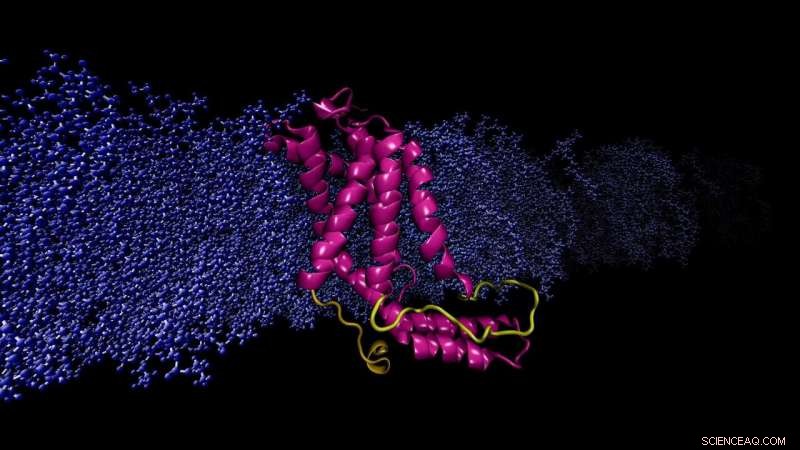
Beregningsmodel YidC2 protein indlejret cellemembran. Den modellerede sløjfe (gul), mangler i røntgenkrystalstrukturen, er afgørende for stabilisering af protein. Kredit:Sogol Moradi
En ny undersøgelse af kemikere ved University of Arkansas viser, at røntgenkrystallografi, standardmetoden til bestemmelse af proteiners struktur, kan give unøjagtige oplysninger om et kritisk sæt proteiner - dem, der findes i cellemembraner - hvilket igen kan føre til et dårligt og ineffektivt lægemiddeldesign.
Forskernes fund blev offentliggjort i dag i Videnskabelige rapporter , en Nature -publikation.
"To tredjedele af alle lægemidler, herunder dem, der bruges til kemoterapi, målproteiner fundet på cellemembraner, "sagde Mahmoud Moradi, adjunkt i kemi og biokemi ved J. William Fulbright College of Arts and Sciences. "Desværre, Røntgenkrystallografi, guldstandarden til bestemmelse af proteiners struktur, har mange begrænsninger ved håndtering af dem, der findes i cellemembranen. Vores arbejde afslører, og på mange måder, forklarer disse begrænsninger. "
Betragtet arbejdshestmolekylerne i celler, proteiner er ansvarlige for næsten enhver opgave i levende systemer. Nogle proteiner lever inde i celler, og nogle ligger på cellens membran, et ydre lag af lipider, der adskiller cellen fra dets ydre miljø. Membranproteiner er kritisk vigtige, fordi de regulerer udveksling af information og materialer mellem cellen og dens miljø, en vital opgave for overlevelse og cellens normale funktion, fordi enhver forstyrrelse i proteinfunktionen kan resultere i sygdom.
Undersøgelsen af proteinfunktion er nødvendig for at forstå det molekylære grundlag for sygdom. At gøre dette, forskere har påberåbt sig røntgenkrystallografi, det primære værktøj til bestemmelse af proteiners form og struktur. Røntgenkrystallografi er også afgørende med henblik på at designe lægemidler, der effektivt manipulerer proteiners funktion. Imidlertid, undersøgelsen af membranproteinstruktur er vanskelig, fordi deres oprindelige miljø ikke er kompatibelt med røntgenkrystallografi. Forskere skal fjerne proteinerne fra deres oprindelige miljø og placere dem i et kunstigt lipidmiljø, før de anvender teknikken.
Moradi og Thomas Harkey - dengang en bachelorstuderende og nu en medicinstuderende ved University of Arkansas for Medical Sciences - behandlede dette problem fra en anden vinkel. I cirka to år, de brugte en supercomputer på Arkansas High Performance Computing Center til at køre kontinuerligt, beregninger på mikrosekundniveau, der simulerer YidC2s molekylære dynamik, et membranprotein med en krystallografisk uløst cytoplasmatisk sløjfe i dens molekylære struktur. Cytoplasmatiske sløjfer er kendt for at have funktionel betydning i membranproteiner.
Moradi og Harkey's simuleringer demonstrerede, at YidC2s cytoplasmiske sløjfe stabiliserede hele proteinet, især C1 -regionen, et potentielt vigtigt område for lægemiddeldesign. Meget polære eller ladede lipidhovedgrupper interagerede med og stabiliserede løkken. Dette fund viste, at uløste sløjfer af membranproteiner kunne være vigtige for stabilisering af proteiner, trods den tilsyneladende mangel på molekylær struktur.
"Typisk, hvis en del af et protein ikke løses ved røntgenkrystallografi, det fortolkes som mangler en særlig struktur, "Moradi sagde." Vi viser, at for membranproteiner og især dele af proteinet, der interagerer med cellemembranen, denne fortolkning er ikke korrekt og kan være vildledende. Vi tror, at den alternative forklaring på lidelsen kan være, at proteinet ikke undersøges i dets oprindelige membranmiljø. "
Moradi sagde, at deres resultater også viste, at beregningskemi og supercomputingsteknologi kan bruges til at modellere membranproteiner mere præcist i et miljø, der efterligner deres fysiologiske miljø.
 Varme artikler
Varme artikler
-
 En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsningFigur 1. Design og bevis på konceptet for nano-porøs membrancentrifuge:(a), (b), og (c) detaljer i nanoskala af vandmolekyler og Na+/Cl-ioner i nærheden af grafenmembranen; (d) illustration rotation
En opskalering af nanoporøs membrancentrifuge til afsaltning af omvendt osmose uden tilsmudsningFigur 1. Design og bevis på konceptet for nano-porøs membrancentrifuge:(a), (b), og (c) detaljer i nanoskala af vandmolekyler og Na+/Cl-ioner i nærheden af grafenmembranen; (d) illustration rotation -
 kolloide geler, allestedsnærværende i hverdagsprodukter, røbe deres hemmelighederDisse partikler, der ligner mikroskopiske kugler af strikkeuld, er faktisk uorganiske zeolitpartikler. De mikroporøse krystallinske partikler dannes via udfældning, efterhånden som de kolloide alumino
kolloide geler, allestedsnærværende i hverdagsprodukter, røbe deres hemmelighederDisse partikler, der ligner mikroskopiske kugler af strikkeuld, er faktisk uorganiske zeolitpartikler. De mikroporøse krystallinske partikler dannes via udfældning, efterhånden som de kolloide alumino -
 Båndets historie:Klæbrige bits gør bedre batterierTil venstre, en kobberstrømsamler med en laserinduceret siliciumoxidbelægning skabt på Rice University. Til højre, et scanningselektronmikroskopbillede af belægningen skabt ved lasning af tape på kobb
Båndets historie:Klæbrige bits gør bedre batterierTil venstre, en kobberstrømsamler med en laserinduceret siliciumoxidbelægning skabt på Rice University. Til højre, et scanningselektronmikroskopbillede af belægningen skabt ved lasning af tape på kobb -
 Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirusDette billede viser den detaljerede struktur af en spids fra en coronavirus, der forårsager forkølelsessymptomer - en mildere slægtning til den virus, der forårsager COVID-19. Pigge binder sig til rec
Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirusDette billede viser den detaljerede struktur af en spids fra en coronavirus, der forårsager forkølelsessymptomer - en mildere slægtning til den virus, der forårsager COVID-19. Pigge binder sig til rec


