Dynamiske billeder viser rhomboid protease i aktion
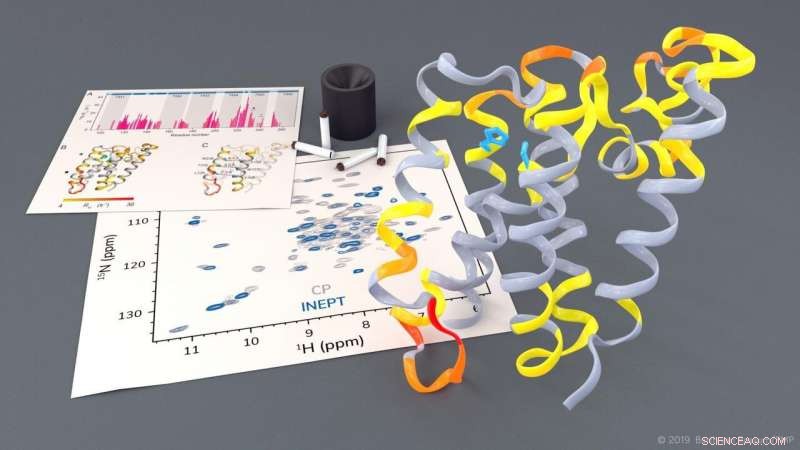
Undersøgelse af rhomboidproteasen GlpG ved faststof-NMR. Kredit:Barth van Rossum, FMP
Rhomboide proteaser er klinisk relevante membranproteiner, der spiller en nøglerolle ved forskellige sygdomme. Ved hjælp af faststof-NMR-spektroskopi, forskere fra Berlins Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) har nu kunnet se rhomboide proteaser i et indfødt lipidmiljø på arbejde. De opnåede dynamiske billeder vil være nyttige til udvikling af ny medicin til sygdomme som Parkinsons og malaria. Resultaterne af dette pionerarbejde er netop blevet offentliggjort i Journal of the American Chemical Society .
Titusinder af proteiner er i gang i vores celler, døgnet rundt. Nogle af disse flittige arbejdere sidder i cellemembranen, blandt dem familien af rhomboide proteaser. I betragtning af at disse intramembrane proteaser er involveret i mange biologiske processer, og spiller også en nøglerolle ved sygdomme som Parkinsons, diabetes, kræft og malaria, de er yderst klinisk relevante.
Tidligere har det havde været muligt at se rhomboide proteaser ved hjælp af røntgenkrystallografi. Imidlertid, denne metode var kun i stand til at tilvejebringe statiske billeder fra proteiner i et kunstigt miljø. Derfor forblev det af stor interesse at se, hvad der sker i cellemembranen, hvor proteinerne udfører deres hovedopgave, som spalter andre membranproteiner, udløser en signalkaskade.
Den længe mistænkte port, der åbner, eksisterer faktisk
Forskningsgruppen ledet af professor Adam Lange fra Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) har nu været i stand til at undersøge denne meget komplekse proces, for første gang ved anvendelse af faststof-NMR-spektroskopi i et native-lignende miljø. Forskerne var i stand til at observere, hvordan visse dele af proteasen bevæger sig. De lagde også mærke til, at for at spalte andre proteiner, en port åbnes kort for at lade disse substratproteiner komme ind i proteasens aktive centrum.
Fund relevante for farmakologisk interferens
Projektet, foretaget inden for UniSysCat Cluster of Excellence, danner grundlag for en endnu bedre karakterisering af rhomboide proteaser. Hvad mere er:Den opnåede viden vil være nyttig for forskere at undersøge, hvordan de farmakologisk kan påvirke de klinisk relevante membranproteiner. Også Lange og hans team ønsker nu at søge efter stoffer for at hæmme fejltagende romboide proteaser.
 Varme artikler
Varme artikler
-
 Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god
Video:Popping balloner med stilKredit:The American Chemical Society Appelsinskræller indeholder limonen, og dette kemikalie er nøglen til et festtrick, hvor du kan springe en ballon med et twist. Limonene er et usædvanligt god -
 Formiat dehydrogenase reducerer kuldioxid til myresyreKredit:Osaka City University Professor Yutaka Amao fra Osaka City University Artificial Photosynthesis Research Center og Ryohei Sato, en 1. års ph.d. studerende ved Graduate School of Science med
Formiat dehydrogenase reducerer kuldioxid til myresyreKredit:Osaka City University Professor Yutaka Amao fra Osaka City University Artificial Photosynthesis Research Center og Ryohei Sato, en 1. års ph.d. studerende ved Graduate School of Science med -
 Forskere arbejder på at skabe mikrochipelementer i molekylær størrelseKredit:CC0 Public Domain Moderne siliciumbaserede integrerede kredsløb (ICer) har nået de praktiske grænser for miniaturisering, mens brugen af organiske stoffer potentielt kan tillade skabelsen
Forskere arbejder på at skabe mikrochipelementer i molekylær størrelseKredit:CC0 Public Domain Moderne siliciumbaserede integrerede kredsløb (ICer) har nået de praktiske grænser for miniaturisering, mens brugen af organiske stoffer potentielt kan tillade skabelsen -
 Særlige højproteinplanter giver proteiner, fibre og antioxidanter i en enkelt pakkeProtein og fiber, g/100g. Kredit:Natural Resources Institute Finland ScenoProt-projektet har analyseret næringssammensætningen og de mest typiske bioaktive forbindelser af højproteinplanter. Analy
Særlige højproteinplanter giver proteiner, fibre og antioxidanter i en enkelt pakkeProtein og fiber, g/100g. Kredit:Natural Resources Institute Finland ScenoProt-projektet har analyseret næringssammensætningen og de mest typiske bioaktive forbindelser af højproteinplanter. Analy
- Hvad er processen med at gøre beton?
- Hvordan en bestemt bakterie kommunikerer og gør os syge
- Blanding af det gamle og det nye - bevaring af klippekunst med et tryk på en knap
- Samsung Electronics siger, at nettoresultatet i fjerde kvartal falder med 38 %
- Video:Arktis:Et delikat iskoldt økosystem
- Udskiftning af diesel med flydende natur fører til en brændstoføkonomi på op til 60%


