Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupper
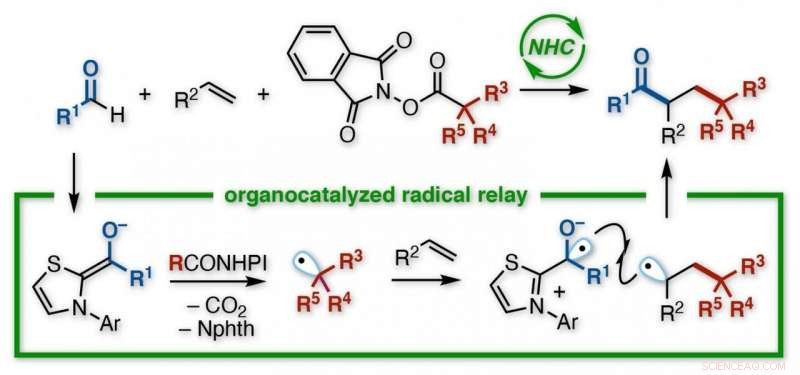
Et japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller eller lysbestråling, en acyl og en alkylgruppe tilsættes over dobbeltbinding af en alken. NHC giver regioselektiv kontrol over en relæproces, der involverer elektronoverførsel efterfulgt af successiv tilsætning af to radikaler til alkenen. De forskellige produkter er nyttige byggesten til yderligere synteser. Kredit:Kanazawa University
Organiske kemikere er molekylære arkitekter, designe sofistikerede strukturer. Efterhånden som molekylerne i videnskab og medicin bliver stadig mere komplekse, nye værktøjer er nødvendige for at samle byggestenene. Nu, et japansk team ved Kanazawa University har udviklet en reaktion, der forbinder tre komponenter på én gang ved hjælp af fri radikal kemi.
Carbon-carbon dobbeltbindinger, kendt som alkener, er mere reaktive end enkeltbindinger. Dette gør dem nyttige til at forbinde forskellige grupper:hvis dobbeltbindingen brydes, to nye molekyler kan tilføjes i hver ende, broet sammen af det nu enkeltbundne tidligere alken.
Kanazawa -teamet så på måder at opnå denne transformation ved hjælp af aldehyder, som indeholder en dobbeltbinding mellem ilt og kulstof, som et af de to molekyler podet på en alken. Som rapporteret i Journal of the American Chemical Society , målet var at skabe højt funktionaliserede ketoner, en vigtig familie af forbindelser i organisk syntese.
Deres valgte metode var en kendt reaktion, stemningsfuldt nok, som et radikalt relæ. Indeholder en uparret elektron, og dermed en halv tom orbital, radikaler (eller frie radikaler) har en tendens til at være grådigt reaktive. Så reaktiv, Ja, at de ikke kan gemmes, men skal genereres in situ ved at piske en elektron af et sted under en reaktion, udløser en kaskade af bindingsbrydning og fremstilling.
Kemikere kan lave radikaler på forskellige måder, men Kanazawa-teamet ville teste en oraganokatalysator, betegnet en N-heterocyklisk carben (NHC). Med et aldehyd som en reaktant, og en funktionaliseret redoxester som den anden, NHC udløste deres transformation til radikaler. Tidligere undersøgelser antydede, at begge radikaler ville reagere hurtigere med en alken end med hinanden.
"Udfordringen med radikale er, at at være så ustabil, de reagerer ofte med sig selv, "siger studieforfatter Kazunori Nagao." Så får du enten dit udgangsmateriale tilbage, eller et biprodukt, i stedet for målet. Vi minimerede dette her. Faktisk, reaktionen forløb som et relæ - først blev alkylradikalet tilsat til et carbon af alkenen, og derefter blev acylgruppen føjet til den anden. "
Den resulterende forbindelse havde en keton og en ester-afledt gruppe bundet til to tilstødende carbonatomer, i et såkaldt vicinal arrangement. Selvom der også forekom en direkte reaktion mellem de forskellige radikaler-hvilket gav et uønsket tokomponentprodukt, i stedet for det alkenbro-trekomponentmål-det var mindre. Desuden, en lang række udgangsmaterialer var kompatible med processen.
"To vigtige punkter er værd at nævne, "siger Hirohisa Ohmiya, tilsvarende forfatter til undersøgelsen. "Først, i modsætning til nogle reaktioner, vores er fri for metalkatalysatorer og behøver ikke en lyskilde til at producere radikaler, gør den grøn og alsidig. Sekund, NHC styrer præcist relæet, så vi kan være selektive i funktionerne hos funktionelle grupper. Vi arbejder nu på en asymmetrisk version for kirale produkter. "
 Varme artikler
Varme artikler
-
 Læring af muslinger:En marin toskallet inspirerer forskere til at lave stærkere polymererBillede af muslinger i deres naturlige miljø:bundet til en sten ved lavvande nær UCSBs campus. Kredit:Dr. Emmanouela Filippidi En lang række polymerbaserede materialer, fra dækgummi og våddragt ne
Læring af muslinger:En marin toskallet inspirerer forskere til at lave stærkere polymererBillede af muslinger i deres naturlige miljø:bundet til en sten ved lavvande nær UCSBs campus. Kredit:Dr. Emmanouela Filippidi En lang række polymerbaserede materialer, fra dækgummi og våddragt ne -
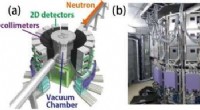 Materialer af apatit-type uden interstitielle oxygens viser høj oxid-ion-ledningsevne ved overbindi…(a) en skematisk figur og (b) et fotografi af SENJU-diffraktometeret installeret på J-PARC-anlægget. (c) Målte single-crystal neutron diffraktionsbilleder. Kredit:J-PARC Forskere ved Tokyo Institu
Materialer af apatit-type uden interstitielle oxygens viser høj oxid-ion-ledningsevne ved overbindi…(a) en skematisk figur og (b) et fotografi af SENJU-diffraktometeret installeret på J-PARC-anlægget. (c) Målte single-crystal neutron diffraktionsbilleder. Kredit:J-PARC Forskere ved Tokyo Institu -
 Et nyt neuralt netværk til at forstå symmetri, fremskynde materialeforskningLavdimensionel ensartet manifold tilnærmelsesprojektion for at visualisere, hvordan neurale netværk lærer semantisk lighed mellem naturlige billeder. Kredit:Joshua Agar/Lehigh University At forstå
Et nyt neuralt netværk til at forstå symmetri, fremskynde materialeforskningLavdimensionel ensartet manifold tilnærmelsesprojektion for at visualisere, hvordan neurale netværk lærer semantisk lighed mellem naturlige billeder. Kredit:Joshua Agar/Lehigh University At forstå -
 Lille skala, store forbedringerKredit:George Hodan/public domain Metoder til at forbedre vandrensning eller bygge bedre batterier er problemer, som har udfordret videnskabsmænd i årtier. Fremskridtene er gået fremad, men stigen
Lille skala, store forbedringerKredit:George Hodan/public domain Metoder til at forbedre vandrensning eller bygge bedre batterier er problemer, som har udfordret videnskabsmænd i årtier. Fremskridtene er gået fremad, men stigen
- På udkig efter usynligt aksion mørkt stof med et nyt flercellet hulrumshaloskop
- Giver mening med et 7.1 jordskælv
- Soldrevet pram en vigtig aflytter for plastaffald
- Hvad indikerer en vedvarende opblomstring af alger om planetens sundhed?
- Sådan fjerner du borsyre
- Hvad skaber en relation til en funktion?


