Sådan finder du molekylære lim til effektivt at målrette sygdomme
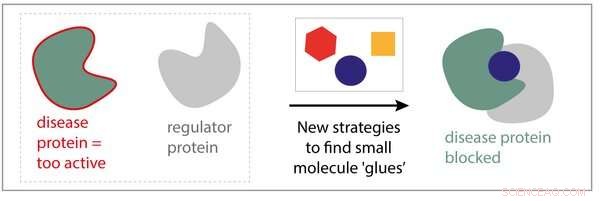
Nye strategier til små molekylære lim. Kredit:Eindhoven University of Technology
Mange af de i øjeblikket tilgængelige lægemidler er ikke specifikke nok til effektivt at helbrede komplekse sygdomme som kræft, neurodegenerative sygdomme og diabetes. Ud over, lægemiddelresistens reducerer effektiviteten af eksisterende terapier. For at løse disse problemer, biomedicinsk ingeniør Eline Sijbesma designet små molekyler, der afvæbner specifikke sygdomsproteiner ved at lime dem til andre proteiner. Disse kan føre til mere stabile og effektive lægemidler og blandt andet, kan bidrage til en ny behandling mod resistent brystkræft, som der i øjeblikket ikke findes nogen behandling for. Sijbesma forsvarer sin ph.d. speciale den 2. december på TU/e.
Hvis du forestiller dig cellen som den mindste fabrik i livet, tænk derefter på proteiner som maskinerne på disse fabrikker, laver alt arbejdet. Ligesom maskiner i en produktionslinje, proteiner fungerer ikke isoleret; de har brug for hinanden for at fungere. Fysiske interaktioner mellem proteiner skaber vigtige signalnetværk, gør det muligt for cellerne hurtigt og tilstrækkeligt at reagere på eksterne signaler. Ved sygdom, ofte fungerer et enkelt protein ikke godt, eller er for aktiv. Aktiviteten af disse sygdomsrelaterede proteiner kan korrigeres ved tæt at binde dem til lægemidler med små molekyler, som kan genoprette deres normale funktion. Imidlertid, denne tilgang er ikke altid vellykket, og selvom den er, syge celler finder ofte måder omkring behandlingen.
To er bedre end en
Eline Sijbesma, Ph.d. studerende i forskningsgruppen kemisk biologi ledet af professor Luc Brunsveld:"I stedet for at fokusere på et enkelt protein og forsøge at finde et specifikt lægemiddel til det, hvorfor sigter vi ikke efter at lave lægemidler, der binder til et kompleks dannet af to proteiner? "Sijbesmas hypotese er, at hvis vi kan udvikle molekyler, der stabiliserer interaktionen mellem et protein og et andet, vi kan muligvis 'lime' et sygdomsprotein til et 'regulatorprotein', der forhindrer dets dårlige aktiviteter. Derudover disse molekyler er meget mere selektive, da de kun binder proteinkomplekset, ikke de to individuelle proteiner, resulterer i færre bivirkninger.
Stram og stærk
Sammen med University of California San Francisco (UCSF) og Novartis Institutes for Biomedical Research (NIBR), Sijbesma var banebrydende i flere strategier til opdagelse af lægemidler ved at bruge meget små molekyler (fragmenter) som udgangspunkt. Sijbesma:"Vi identificerede flere fragmenter med ønskede egenskaber og kombinerede dem på en smart måde, at danne et nyt molekyle med endnu bedre egenskaber. Vi viste, at det nye molekyle faktisk kan binde til to proteinpartnere samtidigt, derved gør proteinkomplekset op til 40 gange stærkere. "
Brystkræft
Udviklingen af disse "molekylære lim" har et stort potentiale for visse former for resistent brystkræft. Sidstnævnte viser ofte en overaktiv receptor (østrogenreceptor α), som i øjeblikket er ineffektivt målrettet mod stoffer, der forsøger at blokere dens aktivitet direkte. I en nylig publikation, Sijbesma viste, at stabilisering af interaktionen mellem denne receptor og et regulatorprotein kan være vejen at gå. Sijbesma:"Denne receptor vides at være nedreguleret af et specifikt protein, navproteinet 14-3-3σ. Dermed, Vi designede molekylære lim, der kan stramme receptoren tæt med dette specifikke protein og inaktivere det.
Ud over kræft
For Sijbesma, den centrale innovation i hendes forskning er etableringen af det underliggende biologiske koncept for en molekylær lim til to proteiner. Dette kan føre til nye veje inden for lægemiddeludvikling og behandling af flere sygdomme. Sijbesma:"Denne tilgang er ikke begrænset til anvendelser inden for brystkræft, men det kan være nyttigt i fremtiden til udvikling af nye terapier til sygdomme som neurodegeneration, betændelse, cystisk fibrose og diabetes. "
Sidste artikelVand var en vinder i opsamling af kuldioxid
Næste artikelForskere afslører strukturen af virale rhodopsiner
 Varme artikler
Varme artikler
-
 Ny metode til mikrobiel energiproduktion opdagetPaul King, David Mulder og Cara Lubner, medforfattere af papiret “Mechanistic Insights into Energy Conservation by Flavin-Based Electron Bifurcation, ”Stå ved siden af en laser kombineret med et spe
Ny metode til mikrobiel energiproduktion opdagetPaul King, David Mulder og Cara Lubner, medforfattere af papiret “Mechanistic Insights into Energy Conservation by Flavin-Based Electron Bifurcation, ”Stå ved siden af en laser kombineret med et spe -
 Kunstige antimikrobielle peptider kan hjælpe med at overvinde lægemiddelresistente bakterierKredit:CC0 Public Domain I løbet af de sidste år har mange bakteriestammer er blevet resistente over for eksisterende antibiotika, og meget få nye lægemidler er blevet tilføjet til antibiotika-ars
Kunstige antimikrobielle peptider kan hjælpe med at overvinde lægemiddelresistente bakterierKredit:CC0 Public Domain I løbet af de sidste år har mange bakteriestammer er blevet resistente over for eksisterende antibiotika, og meget få nye lægemidler er blevet tilføjet til antibiotika-ars -
 Kobberion låser op for magnesium potentiale i næste generations batterierVed at tilføje en kobberion, nyt magnesiumbatteri demonstrerer dramatisk forbedring af ydeevnen. Kredit:CUI Guanglei Forskere ved Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT)
Kobberion låser op for magnesium potentiale i næste generations batterierVed at tilføje en kobberion, nyt magnesiumbatteri demonstrerer dramatisk forbedring af ydeevnen. Kredit:CUI Guanglei Forskere ved Qingdao Institute of Bioenergy and Bioprocess Technology (QIBEBT) -
 Biopolymerer til sårbehandling leverer stamceller for at forbedre helingenFigur viser det celleledende miljø af gellangummi-kollagen IPN-hydrogeler. De indkapslede fedtafledte mesenkymale stamceller (ADSCer) udviser gradvis tilbagevenden af morfologi til deres sædvanlige
Biopolymerer til sårbehandling leverer stamceller for at forbedre helingenFigur viser det celleledende miljø af gellangummi-kollagen IPN-hydrogeler. De indkapslede fedtafledte mesenkymale stamceller (ADSCer) udviser gradvis tilbagevenden af morfologi til deres sædvanlige
- Typer af materialer, der skaber de bedste echoes
- Satellitdata giver værdifuld støtte til IPCC klimarapport
- Science Fair-projekter, der involverer neglelak
- Menneskelig hjerne supercomputer med 1 million processorer tændt for første gang
- Glaspustere i nanoskala:Forskere bruger STM til at ændre størrelsen på glaskapillarrør
- Verdens største rederi til at teste russisk arktisk rute


